
Бесплатный фрагмент - Квантовая химия в примерах
1. Введение
Термин «кристаллография» впервые был предложен швейцарским учёным М. Капеллером в 1723 году. На сегодняшний день значительная доля специалистов по анализу и по классификации химических веществ, несмотря ни на какие обстоятельства, продолжает изучать особенности строения встречающихся в природе минералов, пытаясь решить в общем виде задачу «компактной упаковки шаров». Разумеется, исходя из условий затронутой здесь задачи, шары нужно во что бы то ни стало поместить в прямоугольный ящик. Одновременно с этим свободное пространство, существующее между рассматриваемыми геометрическими фигурами, должно быть минимальным. Несомненно, цель такого рода действий состоит в выделении основных типов кристаллических решёток. Однако для сложной химической структуры часто остаются открытыми вопросы о диаметрах шаров и о габаритах той упаковки, куда помещаются указанные предметы, поскольку именно радиус интересующей нас сферы определяет вид атома, а линейные размеры ящика дают информацию о будущих свойствах построенной в каждом конкретном случае решётки Браве.
В этой работе мы разберём целый ряд методов, ориентированных как на прогнозирование внутреннего строения кристаллов, молекул, аморфных тел и прочих структур, так и на предсказание химических реакций. В итоге, сконструировав специальное устройство и выяснив, пусть даже приблизительно, термодинамические параметры окружающей среды, в которой в конечном счёте произойдёт химический синтез моделируемого вещества на практике, нам останется всего-навсего подтвердить или опровергнуть выдвинутое ранее предположение касательно возможности образования спроектированного материала в реальности. Если в стационарных условиях компоненты изолированной от внешнего воздействия квантовой системы с течением времени t будут перемещаться в пространстве, то на деле составленную из атомов кристаллическую решётку или созданную похожим путём молекулу, вероятнее всего, не удастся получить в лаборатории.
Приятного чтения!
2. Общие положения о строении кристаллов и молекул
Во 2-й главе настоящей монографии мы рассмотрим состоящие из 2-х атомов, имеющих квантовые уровни под номером h=2, химические соединения. В периодической таблице Менделеева наименования исследуемых химических элементов расположены во втором периоде. Последний включает в себя одиночные ионы, начиная от лития Li+ и заканчивая неоном Ne0. Бесспорно, на картинках 2.1, 2.2, 2.3, а также 2.4 можно увидеть фрагменты молекулярных или кристаллических структур, сконструированные из взаимодействующих друг с другом фермионов и бозонов.
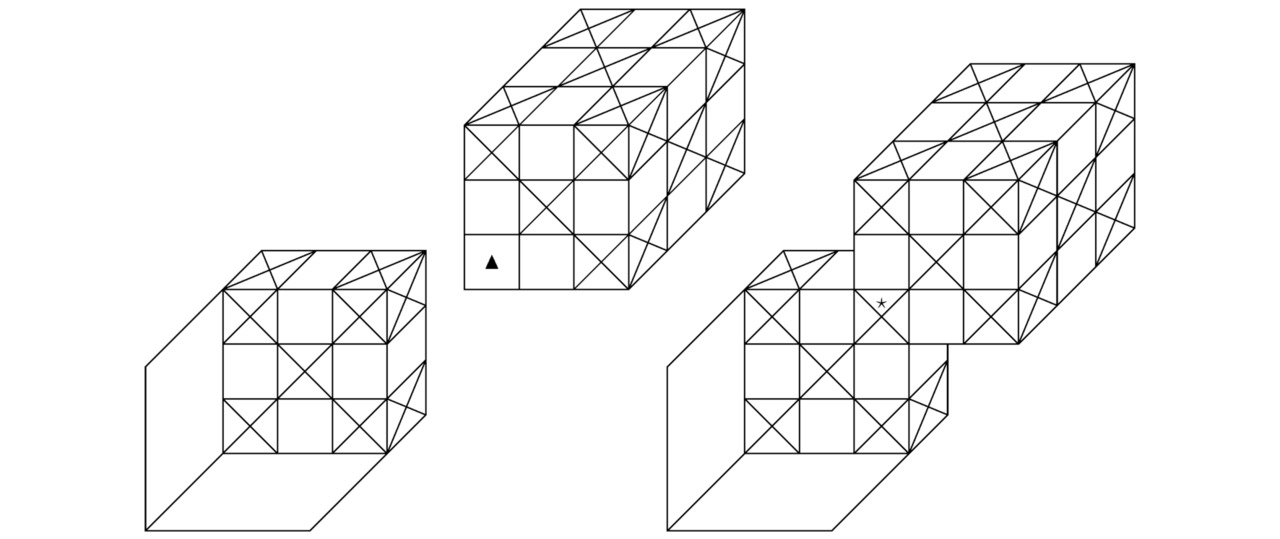
Обозначим крестиками те потенциальные ямы, в которые попадут электроны. Пустые потенциальные ямы, участвующие в образовании химических связей между соответствующими атомами, выделим треугольниками. К слову сказать, в центре каждого из изучаемых в настоящем параграфе химических элементов можно обнаружить положительно заряженное ядро. Области синусоидальной функции A``=ПΘ=13sin (πmΘxΘ/RΘ), где крестики и треугольники объединятся между собой, отметим звёздочками.
Итак, на чертеже 2.1 продемонстрированы 2 пары одиночных ионов, расположенных отдельно друг от друга на размещённом слева рисунке и скреплённых в общую химическую структуру на запечатлённом справа изображении. Далее рассмотрим материальные частицы, визуализированные на эскизе 2.2. Вне всякого сомнения, треугольники, сосредоточенные внутри первого бозона, лежат на одной прямой, вследствие чего в них легко попадают крестики (потенциальные ямы с электронами (в дальнейшем лептонами или фермиономи)) другого химического элемента. Таким образом, на иллюстрации 2.2 возможно увидеть более прочное соединение по сравнению с тем, что было показано на картинке 2.1.
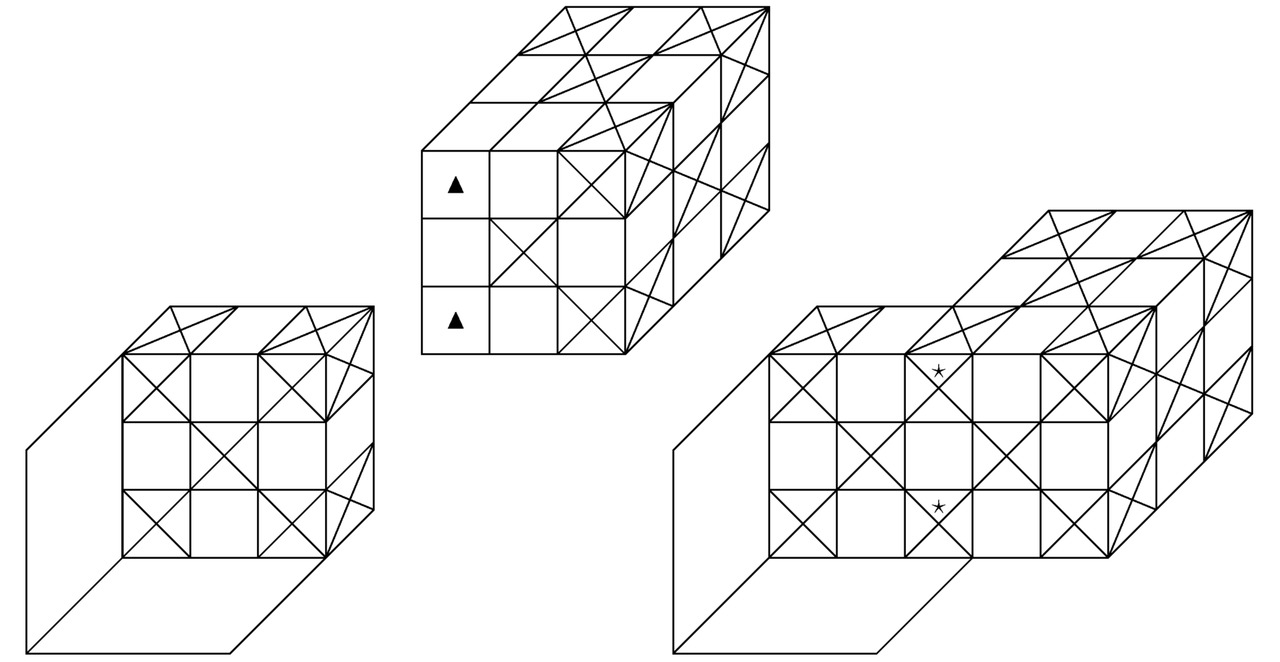
Кстати говоря, наиболее стабильная химическая связь, которая только способна возникнуть между атомами заданной кристаллической структуры или нейтральной молекулы, может сформироваться исключительно при совмещении подходящей пары ионов вдоль 2-х построенных перпендикулярно горизонтальному сечению синусоидальной функции A`` и вместе с тем удовлетворяющих соотношению A``=0 параллельных плоскостей, если z=Rz/ (2mz). Конечно, на чертеже 2.3 продемонстрировано соединение такого рода. Как несложно заметить, на изображении 2.3 в центрах граней взаимодействующих между собой атомов локализованы треугольники. Вообще, данное обстоятельство указывает лишь на то, что синтезированный в природе материал будет проявлять себя как дырочный полупроводник.
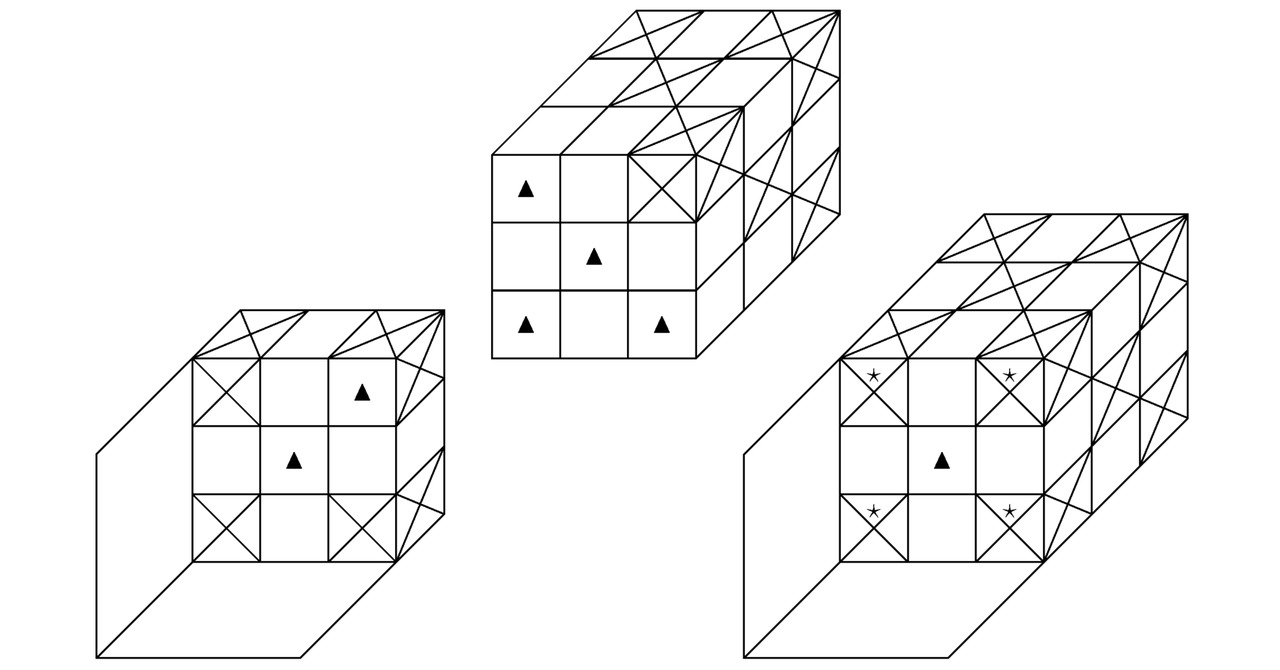
Теперь обратимся к эскизу 2.4. По идее, силы Ван-дер-Ваальса, которые чаще всего возникают при поляризации молекул, а также при образовании диполей, надо учитывать только в том случае, когда абсолютно все имеющиеся в составе исследуемой здесь квантовой системы треугольники окажутся заполненными электронами. Разумеется, ярким примером рассматриваемого сейчас вещества может послужить графен. На практике двумерные кристаллы графена начнут притягиваться друг к другу, образуя трёхмерное атомное соединение графита. Причём Ван-дер-Ваальсово взаимодействие надлежащих частиц будет вносить хоть сколько-нибудь заметный вклад в формирование изучаемой на этом этапе твёрдой субстанции тогда и только тогда, когда общая площадь поверхности соприкосновения монослоёв углерода C устремится непосредственно в сторону возрастания своего значения вплоть до достижения некоторого максимума. Безоговорочно, катионы и анионы, закреплённые в узлах всякой устойчивой химической структуры, останутся неподвижными в пространстве потенциальных ям до тех пор, пока не изменятся полупериоды Rx/mx, Ry/my, Rz/mz, а также Rr/mr, Rθ/mθ, Rφ/mφ интересующих нас синусоидальных функций A`` или B``=sin (πmrr/Rr) sin (πmθθ/Rθ) sin (πmφφ/Rφ).

Если хотя бы один из визуализированных на чертежах 2.1, 2.2 и 2.3 треугольников окажется незанятым тем или иным отрицательно заряженным лептоном, то синтез исследуемого в данный момент химического соединения не получится реализовать в природе. Исключениями, судя по всему, являются те потенциальные ямы, которые, с одной стороны, могут вызвать дырочную проводимость в кристалле, а с другой — будут соответствовать полностью и иногда ровно наполовину свободным подуровням, относящимся собственно к h и более высоким h+1, h+2,…,h+g (g∈N) уровням изучаемого в каждом конкретном случае химического элемента. Примечательно, что для единичного иона натрия Na+, заключённого внутри металла Na2He, 3d10 орбиталь по факту останется пустой. В целом, разобранный выше подход не составит большого труда применить на практике как для моделирования молекул, так и для предсказания кристаллических решёток.
3. «Запрещённая химия» А. Р. Оганова
Как известно, опираясь на эволюционный алгоритм, предложенный А. Р. Огановым, можно с лёгкостью разработать проект практически любой существующей под высоким давлением Pb> 104 МПа кристаллической структуры. «Запрещённые» химические соединения, сконструированные с помощью специально созданной в лаборатории Оганова компьютерной программы «USPEX», как правило, бывают либо двумерными (слоистыми), либо трёхмерными. В 9-м разделе этого пособия мы опишем основные свойства исследуемых в главах 3, 4, 5 и 6 решёток Браве. Совершенно ясно, что время t, отведённое на прогнозирование внутреннего строения каждого из анизотропных кристаллов, в подавляющем большинстве случаев будет зависеть не только от суммы участвующих в расчёте лептонов и ядер, но и от общего количества полученных для указанных частиц квантовых систем.
Принципы, положенные в основу моделирования кристаллических решёток, аморфных тел и так далее:
а) Без сомнения, во всяком устойчивом химическом соединении не должно присутствовать пустых потенциальных ям, в которые рано или поздно попадут отрицательно заряженные электроны. Тем не менее исключениями являются абсолютно все незанятые лептонами потенциальные ямы, соответствующие полностью, а также ровно наполовину свободным подуровням, имеющимся в составе орбитальной диаграммы каждого из зафиксированных в узлах надлежащей элементарной ячейки атомов. Безоговорочно, прибегая к формулам (8.1) или (8.2) (см. раздел 8 [1]), возможно определить минимальное число локализованных в том или ином одиночном ионе треугольников. Вдобавок ко всему, необходимо дополнительно взять в расчёт сумму тех потенциальных ям, которые будут отвечать за дырочную проводимость, если последняя появится в веществе.
б) Неудивительно, что внутри абсолютно любого однородного материала всегда наблюдается симметрия. Беспрекословно, при выполнении настоящего условия во всякой изолированной от внешнего воздействия квантовой системе обязательно установится электростатическое равновесие между положительными ядрами и отрицательными лептонами.
в) Конечно, конструктивные элементы молекул или кристаллических решёток должны располагаться в пространстве потенциальных ям наиболее компактным образом друг относительно друга. Если исследуемая здесь атомная структура окажется менее компактной, чем прочие химические соединения, обладающие похожим набором простых и/или сложных ионов, то смоделированное ранее вещество нельзя будет синтезировать в лаборатории.
г) Итак, кристаллы характеризуются строгой пространственной периодичностью в расположении составляющих их материальных частиц. Под периодичностью понимают повторяемость элементов решётки в том или ином направлении. Очевидно, что указанное требование не распространяется на квазикристаллы.
В случае, когда построенная из атомов химическая структура будет удовлетворять разобранным в пунктах а), б), в) и г) правилам, тогда потенциальная энергия надлежащей квантовой системы U0p примет минимальное значение U0p=min. Таким образом, в реальных природных условиях катион водорода H+, например, устремится к центру грани другого присоединяемого непосредственно к изучаемому гидрогену H+ химического элемента.
3.1 Динатриевый гелид
В этом параграфе мы рассмотрим металл Na2He, существующий под высоким давлением Pb≈113 ГПа. В дальнейшем на эскизах 3.1–6.2 жирным шрифтом будут обозначаться наименования закреплённых в узлах исследуемых химических соединений видимых ядер, а обычным — невидимых. Теперь отыщем сумму треугольников, сосредоточенных внутри каждого из нейтральных ионов гелия He0, тогда:
Tr (He) =0
Для натрия Na целую положительную величину Tr (Na) можно определить из математического выражения:
Tr (Na) =48—11+10—30=17
здесь 48 — расчётное количество заполненных и незаполненных потенциальных ям, расположенных на наружной оболочке проектируемого в настоящий момент гексаэдра (атома) уровня h=3 (см. таблицу 8.1 столбец 3 [1]);
11 — порядковый номер натрия Na, взятый из периодической таблицы Менделеева;
10=30/3 — ядерный заряд бозона неона Ne;
30 — трёхкратное количество электронов, сгруппированных на скрытых оболочках интересующего нас куба уровней h=1 и h=2.
Так вот, основные компоненты элементарной ячейки динатриевого гелида Na2He продемонстрированы на изображениях 3.1 и 3.2.
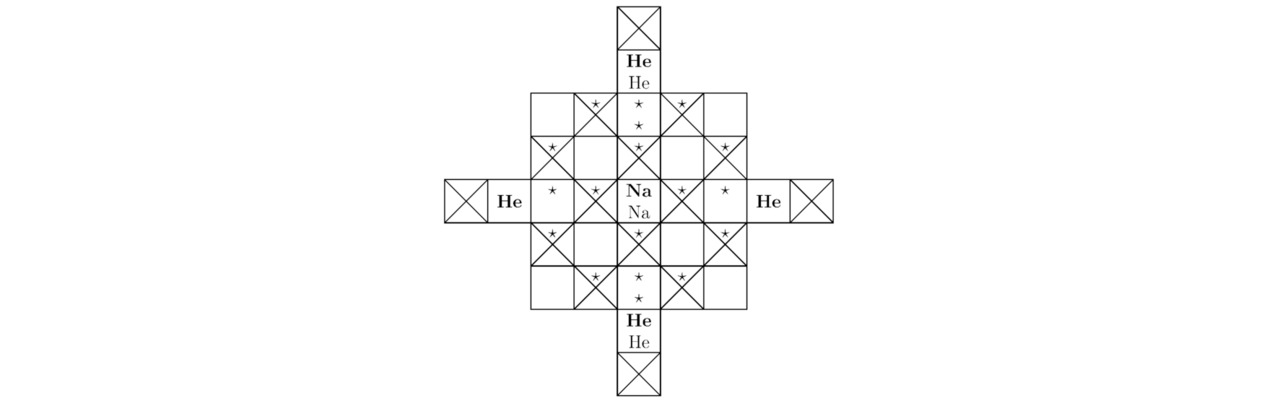
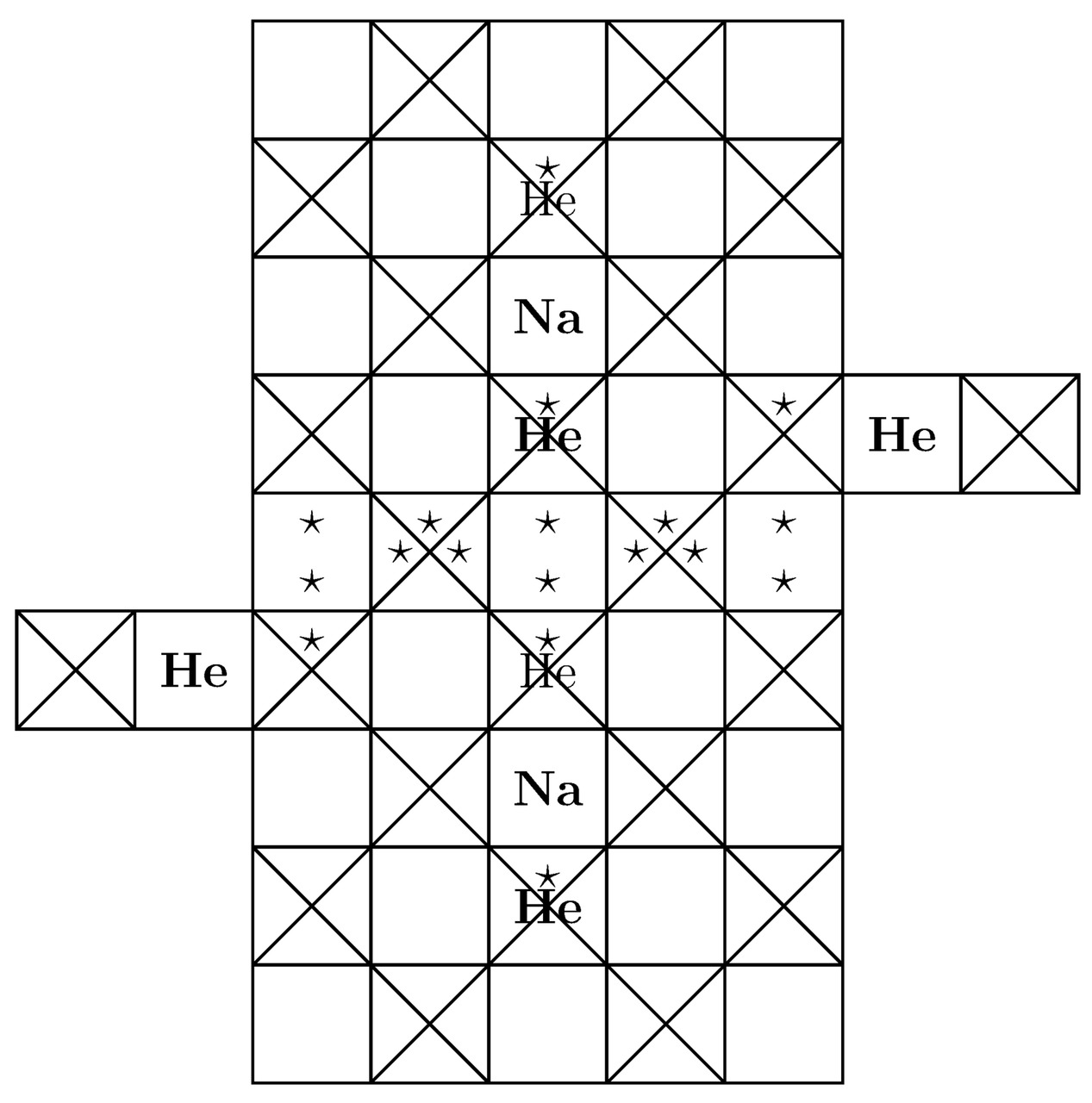
Далее вычислим минимальное количество крестиков Kr (Na) для натрия Na, следовательно:
Kr (Na) =48—17=3
Для гелия He натуральный коэффициент Kr (He) будет равен:
Kr (He) =2
В процессе формирования кристаллической решётки динатриевого гелида Na2He относящийся собственно к самой орбитальной диаграмме каждого из атомов натрия Na 3d10 подуровень по факту останется пустым. Таким образом, искомое значение дискретной переменной Tr (Na) без учёта свободно блуждающих лептонов составит:
Tr (Na) =17—10=7
где 17 — сумма заключённых внутри катиона натрия Na+ незанятых потенциальных ям, а 10 — полное число фигурирующих на 3d10 орбитали и вместе с тем ограниченных со всех сторон проведёнными через точки A``=0 прямыми или кривыми линиями областей конкретно заданной синусоидальной функции A`` <0.
Для того чтобы найти общее количество треугольников Tr (Na), содержащихся в единичном ионе натрия Na+, необходимо дополнительно взять в расчёт 2 отрицательно заряженные частицы, вытесненные на 4-й квантовый уровень h=4, тогда Tr (Na) =7+2=9. Если 3p6 подуровень, принадлежащий внешней оболочке фермиона натрия Na (правильного шестигранника), окажется полностью свободным, то в этом случае математическая величина Tr (Na) примет следующее значение: Tr (Na) =9-6-2=1. Почти всегда в ходе неравномерного преобразования формы пространства потенциальных ям внутренняя энергия u, определяемая для исследуемого твёрдого тела, будет изменяться во времени t. К тому же каждый из атомов изучаемой здесь химической структуры во что бы то ни стало начнёт перемещаться относительно того или иного неподвижного объекта в сторону минимизации физического параметра U0p-> min. Если полупериоды Rr/mr, Rθ/mθ и Rφ/mφ соответствующей синусоидальной функции B`` стабилизируются, то изолированная от внешнего воздействия квантовая система перейдёт из нестационарного состояния в стационарное или в квазистационарное.
3.2 Дифторогелид кальция
Сначала вычислим сумму треугольников Tr (F) для фтора F, следовательно:
Tr (F) =14-6-9+2=1
где 14 — расчётное количество заполненных и незаполненных потенциальных ям, существующих на наружной оболочке проектируемого на этом этапе атома (правильного гексаэдра) уровня h=2 (см. таблицу 8.1 столбец 3 [1]);
6 — трёхкратное количество электронов, размещённых на первом квантовом уровне h=1;
9 — порядковый номер фтора F, взятый из периодической таблицы Менделеева;
2=6/3 — заряд ядра атома гелия He.
После чего отыщем общее число треугольников Tr (Ca) для кальция Ca, тогда:
Tr (Ca) =48—20+10—30=8
здесь 48 — расчётное количество занятых и незанятых потенциальных ям, сконцентрированных на внешней оболочке интересующего нас одиночного иона (правильного шестигранника) уровня h=3;
20 — порядковый номер кальция Ca, взятый из таблицы Менделеева;
10=30/3 — ядерный заряд атома неона Ne;
30 — трёхкратное количество электронов, зафиксированных на скрытых оболочках исследуемого в настоящий момент куба (бозона) уровней h=1 и h=2.
Наконец, найдём полное количество крестиков Kr (F) для фтора F, следовательно:
Kr (F) =14—1=13
Для кальция Ca искомая величина Kr (Ca) окажется равной:
Kr (Ca) =48—8=40
Примечательно, что сумма треугольников Tr (He) для гелия He была вычислена в примере 3.1. Напоследок изобразим на чертежах 3.3 и 3.4 2 проекции элементарной ячейки дифторогелида кальция CaF2He на соответствующие координатные плоскости, тогда:
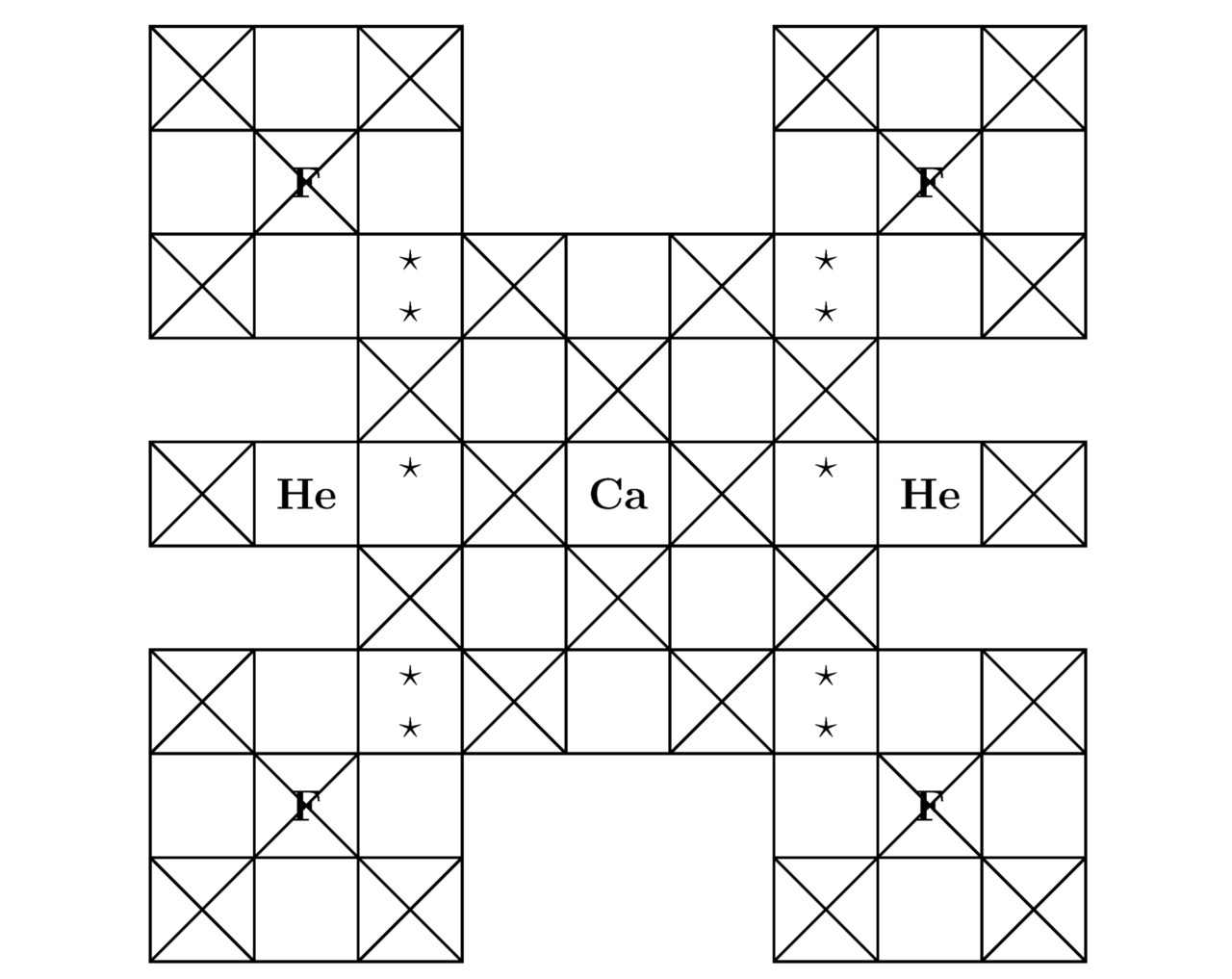
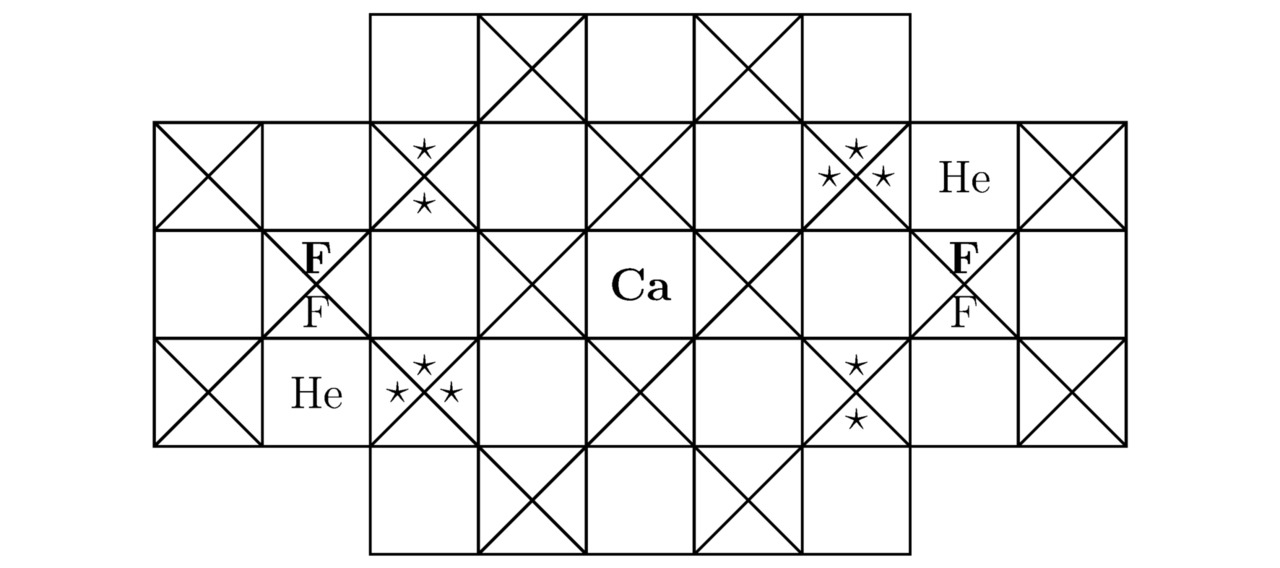
3.3 Дифторогелид магния
Итак, акцентируясь на особенностях строения материала CaF2He, смоделируем кристалл MgF2He. Естественно, что во всякой изолированной от внешнего воздействия экспериментальной камере в результате синтеза той или иной химической субстанции реагирующие между собой компоненты расположатся в пространстве потенциальных ям наиболее компактным образом друг относительно друга, не нарушив при этом законов симметрии. Бесспорно, рассматриваемое здесь вещество MgF2He не является исключением. Ниже мы построим лишь одну из модификаций моделируемой в настоящем примере кристаллической структуры MgF2He. Теперь определим общее количество треугольников Tr (Mg) для магния Mg без учёта свободно блуждающих электронов, следовательно:
Tr (Mg) =48-30-12+10—10=6 (3.1)
Конечно, имеющийся в составе орбитальной диаграммы положительного иона магния Mg 4s2 подуровень будет полностью заполнен отрицательно заряженными лептонами, тогда Tr (Mg) =8;
где 48 — расчётное количество свободных и несвободных потенциальных ям, находящихся на наружной оболочке упомянутого ранее правильного шестигранника (атома) уровня h=3;
30 — трёхкратное количество электронов, закреплённых на скрытых оболочках интересующего нас гексаэдра (бозона) уровней h=1 и h=2;
12 — порядковый номер магния Mg, взятый из периодической таблицы Менделеева;
10=30/3 — заряд ядра атома неона Ne;
10 — максимальное количество вакантных потенциальных ям, принадлежащих 3d10 орбитали.
Затем найдём сумму крестиков Kr (Mg), сгруппированных внутри единичного катиона магния Mg2+, изображённого на каждом из эскизов 3.5 и 3.6. Итого:
Kr (Mg) =48-8-10=30
Вообще, расчётные параметры для гелия He и для фтора F были вычислены в примерах 3.1 и 3.2 соответственно. Так вот, основные компоненты кристаллической решётки дифторогелида магния MgF2He показаны на иллюстрациях 3.5 и 3.6.
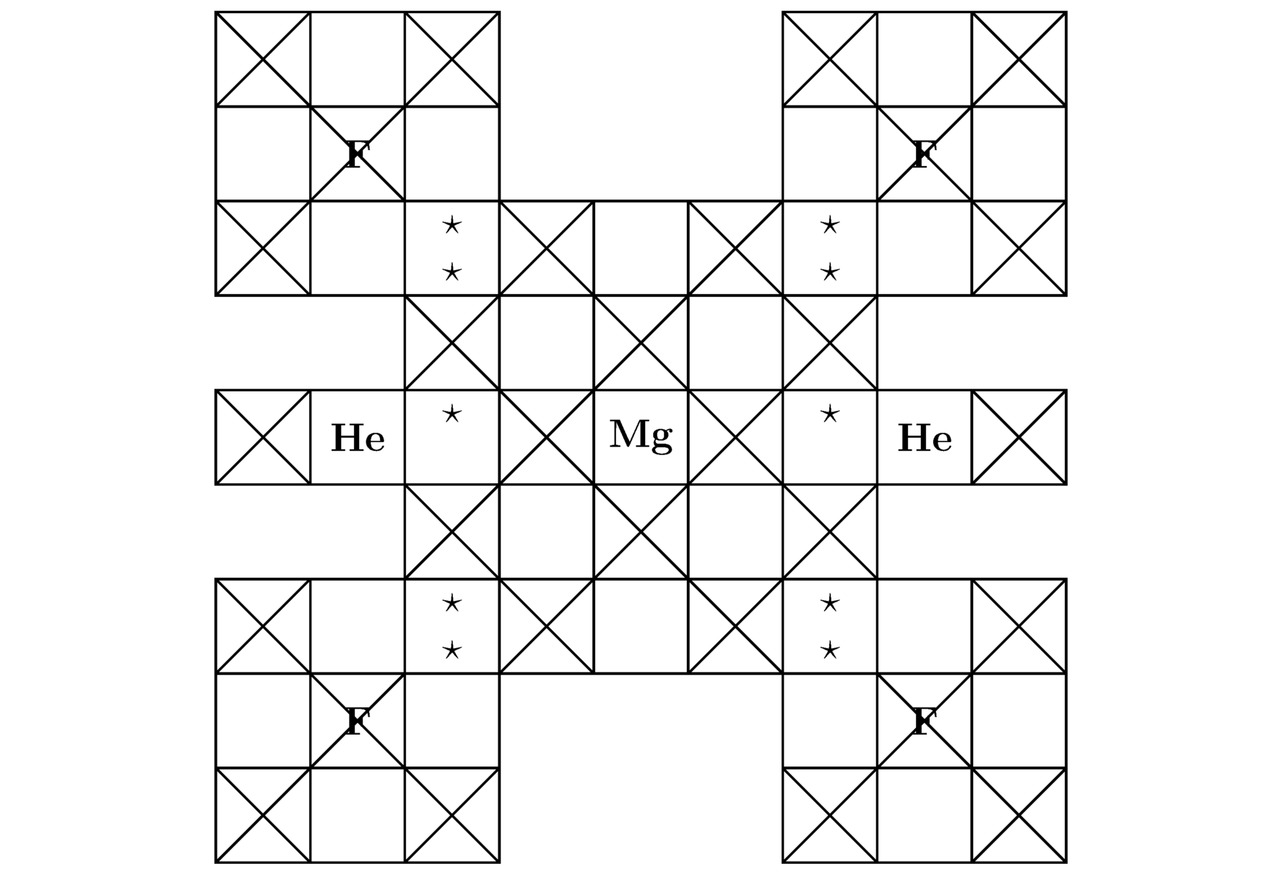
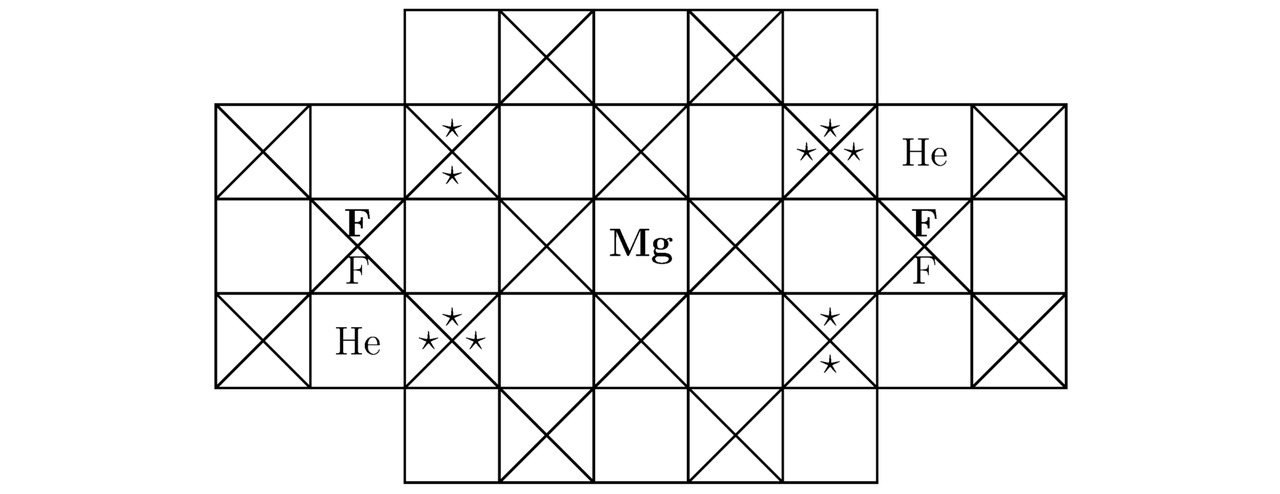
Вдобавок ко всему, смоделированный в настоящей подглаве металл является проводником электрического тока, поскольку в процессе поиска наиболее компактной элементарной ячейки MgF2He произошло заполнение 2-мя лептонами содержащегося в орбитальной диаграмме централизаванного на картинках 5.5 и 5.6 атома магния Mg 4s2 подуровня.
3.4 Тригидрид серы
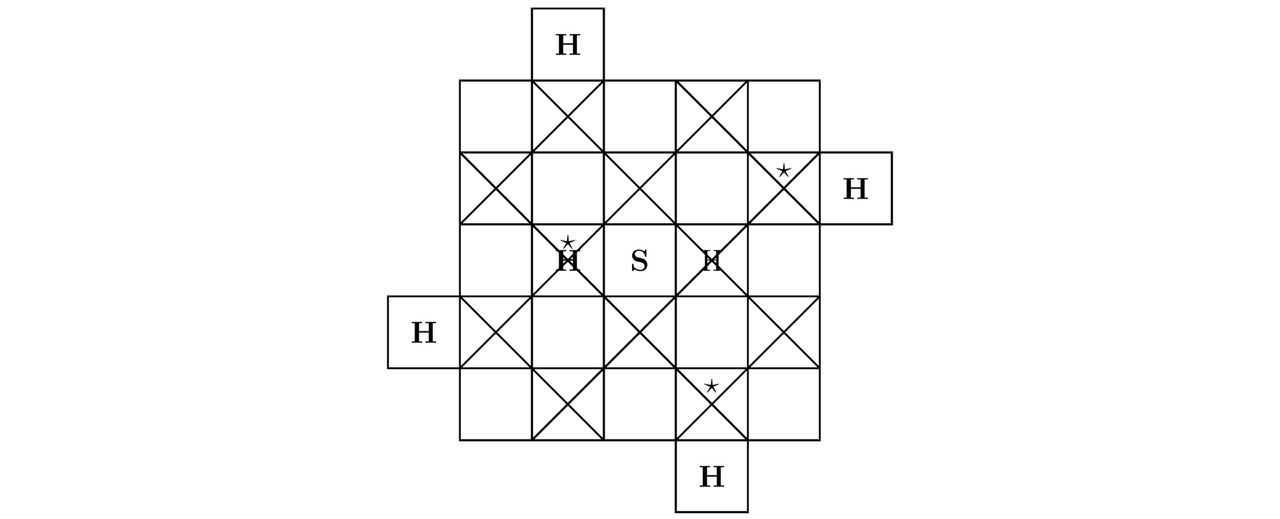
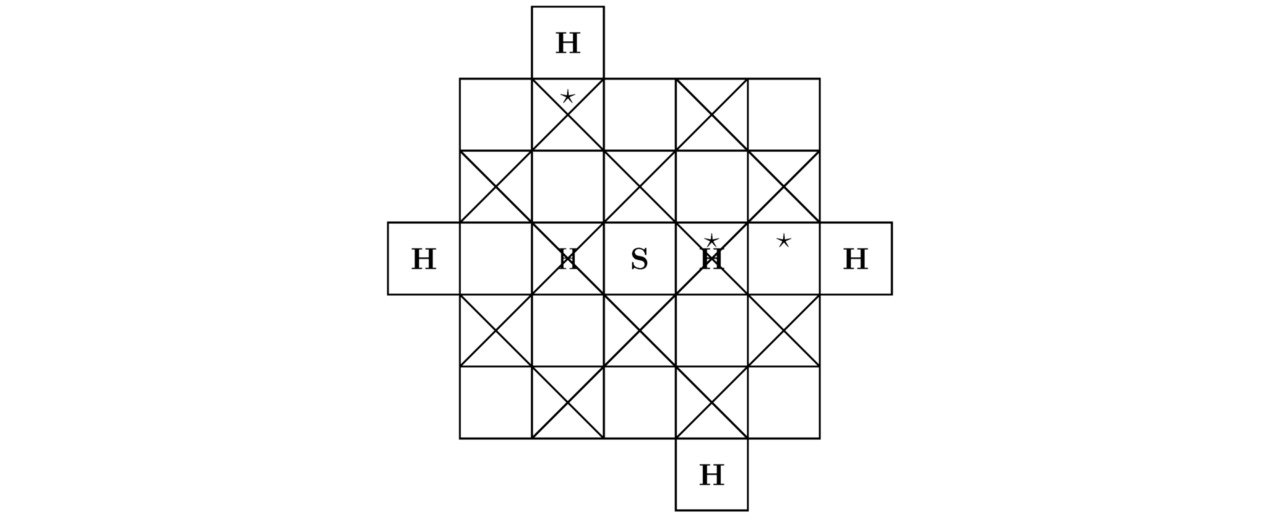
Сперва отыщем сумму треугольников Tr (H) для водорода H, тогда:
Tr (H) =1
Для серы S целая положительная величина Tr (S) составит:
Tr (S) =48-30-16+10—10=2
здесь 48 — расчётное количество занятых и незанятых потенциальных ям, расположенных на внешней оболочке интересующего нас правильного шестигранника (одиночного иона) уровня h=3;
30 — трёхкратное количество электронов, зафиксированных на скрытых оболочках упомянутого ранее куба (бозона) уровней h=1 и h=2;
16 — порядковый номер серы S, взятый из таблицы Менделеева;
10=30/3 — ядерный заряд атома неона Ne;
10 — максимальное количество вакантных потенциальных ям, находящихся на 3d10 орбитали.
Далее вычислим общее число крестиков Kr (H) для водорода H, следовательно:
Kr (H) =1
Для серы S целый положительный коэффициент Kr (S) примет натуральное значение:
Kr (S) =48-2-10=36
По своим свойствам моделируемое сейчас твёрдое тело H3S является высокотемпературным сверхпроводником. Действительно, тригидрид серы H3S возможно синтезировать в лаборатории из сульфида водорода H2S, если повысить внешнее давление Pb в пределах экспериментальной установки до 1,5 млн. атмосфер и понизить абсолютную температуру T, например, до 197,5K. При данных термодинамических параметрах Pb≈152 ГПа и T=197,5±6,5K опытный образец H3S будет иметь нулевое электрическое сопротивление R`≈0 Ом, что в конечном счёте приведёт к возникновению сверхпроводимости внутри изучаемого в этом подразделе вещества. Как нетрудно догадаться, на чертежах 3.7 и 3.8 продемонстрированы 2 проекции кристаллической решётки тригидрида серы H3S на надлежащие координатные плоскости.
3.5 Пентазолид натрия
Само собой разумеется, в современных научных исследованиях иногда поднимается вопрос о хранении нестабильных при нормальных условиях окружающей среды (P=0,101325 МПа и T=273,15K) материалов. К последним можно отнести пентазол HN5, химическая структура которого показана на картинке 3.9.
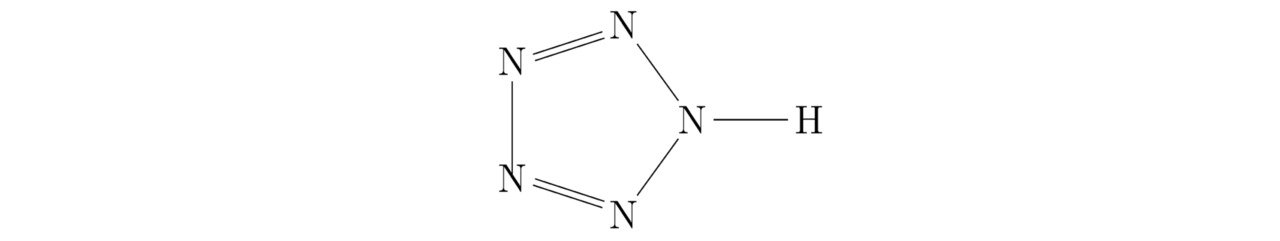
Прежде чем приступить к доказательству того, что устойчивую молекулу пентазола HN5 нельзя будет получить в чистом виде на практике, надо сначала определить минимальное количество свободных потенциальных ям, участвующих в химическом взаимодействии атомов водорода H и азота N. Итак, вычислим сумму треугольников Tr (N) для отрицательно заряженной частицы азота N3-, следовательно:
Tr (N) =14-7-6+2=3
где 14 — расчётное количество занятых и незанятых потенциальных ям, расположенных на наружной оболочке проектируемого на этом этапе единичного иона (правильного шестигранника) уровня h=2;
7 — порядковый номер азота N, взятый из периодической таблицы Менделеева;
6 — трёхкратное количество электронов, закреплённых на предыдущей оболочке изучаемого здесь куба (фермиона);
2=6/3 — заряд ядра атома гелия He.
Как известно, общее количество треугольников Tr (H) для водорода H было найдено в примере 3.4. Кроме того, искомая величина Tr (Na) примет натуральное значение, численно равное Tr (Na) =12, поскольку в сложившейся ситуации 3d10 подуровень, относящийся собственно к самой орбитальной диаграмме каждого из надлежащих катионов натрия Na+, окажется заполненным ровно наполовину. Далее определим сумму крестиков Kr (N) для азота N, тогда:
Kr (N) =14—3=11
К слову сказать, атомная структура моделируемого тут химического соединения HN5 изображена на чертеже 3.10.
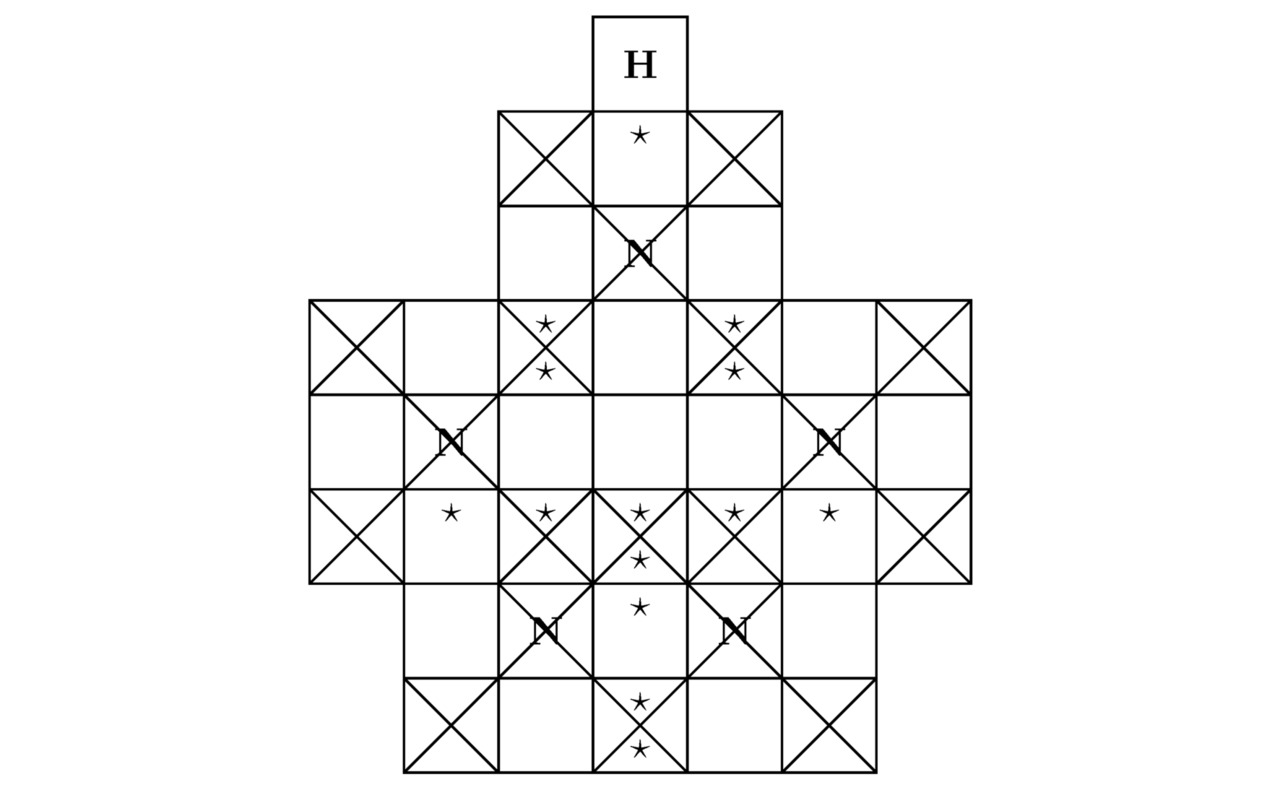
Беспрекословно, внутри молекулы пентазола присутствует один лишний треугольник. В связи с этим в рассматриваемом веществе может нарушиться электростатическое равновесие между положительными ядрами и отрицательными лептонами, когда ∑Fe≠0. Примечательно, что дырочная проводимость, возникающая в результате образования вакантных потенциальных ям, сконцентрированных на внешних оболочках соединённых друг с другом атомов, обусловлена чаще всего внедрением небольшого количества примесей в ту или иную однородную химическую структуру, что в принципе нехарактерно для пентазола. Именно поэтому пентазол является нестабильным материалом. Бесспорно, чтобы вырастить кристалл пентазолида натрия NaN5 в лаборатории, необходимо и достаточно поместить положительно заряженные частицы натрия Na+ и нейтральные молекулы пентазола HN5 в такое замкнутое пространство, где будет существовать давление Pb порядка 20 ГПа. Вообще, основные компоненты элементарной ячейки пентазолида натрия NaN5 продемонстрированы на картинках 3.11 и 3.12.
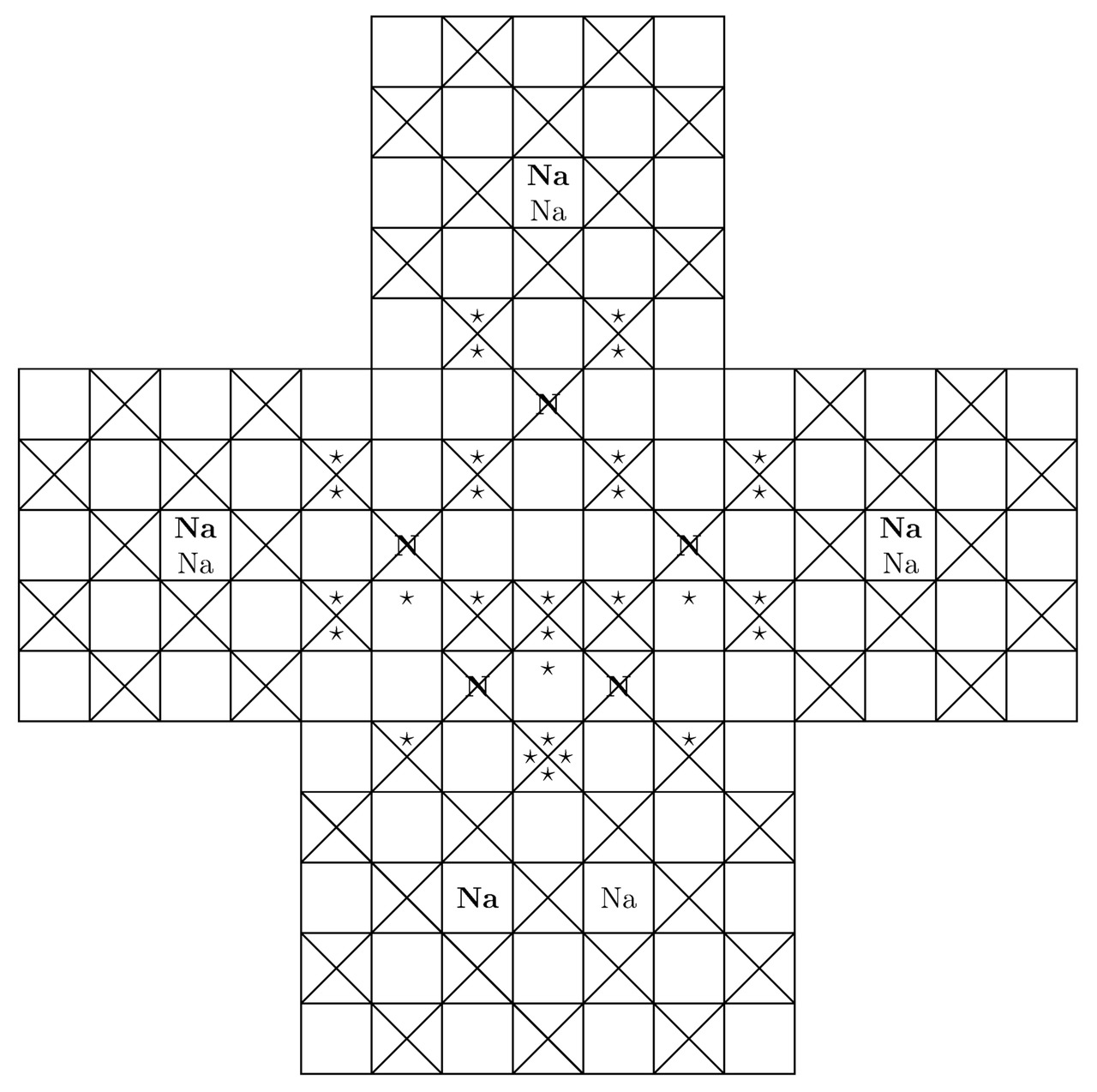

Вывод: Конечно, сконструированные в этой части книги «Квантовая химия в примерах» анизотропные материалы непохожи на встречающиеся в природе при нормальных условиях окружающей среды вещества. Главным отличием является то, что рассмотренные выше химические соединения могут содержать в себе неучтённые в процессе вычислений свободно блуждающие электроны. Помимо этого, в результате химического синтеза нередко происходит образование несимметричной кристаллической структуры. Для того чтобы скомпенсировать силы, направленные в сторону разрушения химических связей, возникающих между атомами полученной на практике твёрдой субстанции, нужно первым делом создать высокое давление Pb внутри специально подготовленного реактора.
4. Моделирование кристаллических структур, существующих в стандартных условиях окружающей среды
В данной главе мы разберём особенности строения следующих химических веществ: медь Cu, цинк Zn, графит C, алмаз C, хлорид натрия NaCl, фторид цезия CsF и других. Безоговорочно, перечисленные здесь кристаллы могут быть синтезированы в лаборатории при нормальном давлении P.
4.1 Медь
Вне всякого сомнения, общее число треугольников Tr (Cu), определяемое для каждого из одиночных ионов меди Cu0 без учёта свободно блуждающих лептонов, составит:
Tr (Cu) =48—29+10—30=-1 (4*)
где 48 — расчётное количество занятых и незанятых потенциальных ям, расположенных на наружной оболочке интересующего нас гексаэдра (атома) уровня h=3;
29 — порядковый номер меди Cu, взятый из таблицы Менделеева;
10=30/3 — ядерный заряд бозона неона Ne;
30 — трёхкратное количество электронов, зафиксированных на предыдущих оболочках упомянутого ранее правильного шестигранника (фермиона) уровней h=1 и h=2.
Очевидно, что сумма треугольников Tr (Cu), заключённых внутри обособленного от всей остальной квантовой системы нейтрального иона меди Cu0, будет равна Tr (Cu) =1, поскольку 4s2 подуровень, относящийся непосредственно к наиболее устойчивой электронной конфигурации изучаемого в этом примере химического элемента, по факту окажется завершённым. Теперь вычислим целое количество крестиков Kr (Cu), присутствующих в изолированном от внешнего воздействия атоме меди Cu, следовательно:
Kr (Cu) =48- (-1) -2=47
Так вот, на чертежах 4.1 и 4.2 визуализированы 2 проекции разбираемого сейчас кристалла Cu на надлежащие координатные плоскости.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.