
Бесплатный фрагмент - Аутоиммунная пузырчатка
От истоков развития до наших дней
Предисловие
На протяжении всего периода существования человека пузырчатка остается одним из самых загадочных заболеваний, к которому до сегодняшнего дня не ослабевает интерес ученых, исследователей и клиницистов всех стран мира. Известная еще со времен Гиппократа, она представляет собой уникальную модель по изучению аутоиммунных процессов, конечной целью которой является создание специфической терапии.
За последние шесть-семь десятилетий сделано немало открытий в области изучения этиологии, патогенеза и лечения аутоиммунной пузырчатки. Выявлены специфические IgG-аутоантитела к антигенам десмосомального аппарата многослойного плоского эпителия. Определены мишени, входящие в состав системы десмосом, — разные молекулы адгезии и гликопротеины.
Технологическая революция, совершившаяся в диагностике аутоиммунных буллезных дерматозов, позволила дифференцировать аутоиммунную пузырчатку от других буллезных дерматозов.
Эпоха открытия глюкокортикостероидов в медицине позволила сохранить жизнь пациентов, страдающих таким тяжелым заболеванием, протекающим, как правило, на фоне отягощенного соматического анамнеза. Еще до середины прошлого столетия, до эры глюкокортикостероидов, заболевание, как известно, заканчивалось летальным исходом.
До сих пор системные глюкокортикостероидные гормоны остаются основными (базовыми) препаратами, купирующими активные проявления аутоиммунной пузырчатки и не имеющими абсолютных противопоказаний при их назначении. Однако, как показывает многолетний опыт, успехи, достигнутые в первоначальном подавлении аутоиммунного процесса, результатом которого является клиническая ремиссия болезни, могут быть утрачены в течение дальнейшего наблюдения и ведения пациента на амбулаторном уровне. Поэтому роль клинициста в жизни каждого пациента на любом этапе развития и течения его болезни не должна ослабевать, а лишь неуклонно приобретать функциональную значимость и виртуозность в искусстве врачевания, итогом которой является сохранение длительной клинической ремиссии болезни, активного образа жизни и социального статуса пациента. Все это достигается за счет индивидуальной, правильно подобранной минимальной поддерживающей дозы системного глюкокортикостероида. Длительность приема дозы преднизолона после каждого ее снижения индивидуальна и зависит как от общего самочувствия и образа жизни пациента, так и от сопутствующей соматической патологии и ряда факторов, способных вызвать обострение болезни.
Книга представляет собой клинический и научный труд, накопленный в течение многих десятилетий профессиональной жизни авторов, с элементами исторического ракурса и результатами ряда фундаментальных исследований в области познания сущности истинной (аутоиммунной) пузырчатки.
Представлены описания классических и редких форм аутоиммунной пузырчатки, принципы диагностического подхода и проводимых лечебных мероприятий в условиях стационара и поликлиники отечественного здравоохранения. Необходимо отметить, что на настоящем этапе развития медицины преодоление прогрессирования аутоиммунной пузырчатки и достижение длительной ее клинической ремиссии — это реальность. А включение молекулярно-биологических методов исследования в изучение патофизиологических процессов при данном буллезном дерматозе приближает нас к генетическому уровню и созданию персонифицированного подхода в лечении столь угрожающего для жизни заболевания.
Авторы выражают глубокую надежду, что монография вызовет интерес и станет полезной настольной книгой для практикующего врача и исследователей, работающих в области иммунопатологии и аутоиммунных процессов.
Данное издание рукописи не претендует на исчерпывающий труд, оно лишь охватывает ту малую часть научных достижений, которая способна приоткрыть читателю «занавес» сложного механизма возникновения и течения болезни. Последовательно углубленное изучение иммунопатологического процесса аутоиммунной пузырчатки на протяжении не одного десятка лет — это яркий пример дара ученичества и преемственности многих поколений ученых и клиницистов, итогом работы которых являются расширение клинического кругозора и внедрение научных достижений в практическое здравоохранение.
Авторы выражают глубокую признательность и искреннюю благодарность всем ученым и клиницистам отечественной медицины, внесшим значительный вклад в область изучения аутоиммунной пузырчатки.
Москва, февраль 2016 г.
Наталия Викторовна Махнева
Наталия Павловна Теплюк
Людмила Вячеславовна Белецкая
Глава 1.
Краткие исторические сведения
о процессах познания
истинной сущности
акантолитической пузырчатки
Заболевания кожи, характерным признаком которых является пузырь, известны со времен глубокой древности. «Греческий» период развития медицины, век Гиппократа, Перикла, Фидия, Сократа, Платона и Аристотеля, Геродота, Фукидида, Софокла и Аристофана, нашел свое отражение и в истории пузырчатки [Потекаев Н. С. с соавт., 2012].
Гиппократ (460—370 лет до н.э.) первым отделил медицину как от религии, так и от философии и указал для нее путь клинических наблюдений, представил довольно точное описание некоторых болезней кожи и многим дал названия, которыми мы пользуемся по настоящее время [Никольский П. В., 1928]. Он писал о поражениях кожи, устрашающих взор (pityroi pemphigoides), и впервые применил слово пемфигус (от греческого Πεμφίξ — возвышение эпидермиса, заполненное жидкостью) [Картамышев А. И., 1963]. Однако заболевание, на которое указывал Гиппократ, носило сезонный характер и не являлось истинным пемфигусом [Машкиллейсон А. Л., 1959].
Мансуров Н. П. (1863), на основании исследований Hebra F., обратил внимание на то, что Πεμφίξ, а также Πομφοί и Πομφόλυγες обозначали не только возвышение «кожицы» (эпидермиса), но и пространства, заполненные воздухом. Интересно также, что другое значение этих слов — «душа» (дыхание) или «дух» [Мансуров Н. П., 1863; Шеклаков Н. Д., 1961].
Время великого переселения народов совершенно затормозило развитие науки вообще и медицины в частности, которые возрождаются у арабов (IX, X, XI и XII вв.). Арабские ученые перевели на арабский язык сочинения греческих и латинских писателей, в том числе и медицинские, и сами внесли в науку новые наблюдения [Никольский П. В., 1928]. Так, Абу-Али-Ибн-Сина (Авиценна) (1020) отмечал, что «прыщи бывают водяные, как (например) волдыри, и воздушные, как (например) пузыри» [Шеклаков Н. Д., 1961].
До ХVI в. пемфигус рассматривался как необычная разновидность других дерматозов, и в европейской литературе средних веков отсутствовали указания на это заболевание [Машкиллейсон А. Л., 1959].
Первое клиническое описание пузырчатки, вероятно, принадлежит Koenig S. (1681) из Берна. Он сообщил о случае развития генерализованного пузырного заболевания у женщины в возрасте 25 лет, длительность которого составляла восемь месяцев и которое проявлялось возникновением пузырей на неизмененной коже с сопровождением токсической реакции. Однако названия этому заболеванию он не дал [Машкиллейсон А. Л., 1959; Шеклаков Н. Д., 1961].
François Boissier de la Croix de Sauvages (1760) первым включил pemphigus в классификацию заболеваний кожи. Однако клинические признаки различных буллезных дерматозов, представленных им, не соответствовали проявлениям болезни, известной на сегодняшний день как истинная акантолитическая пузырчатка [Машкиллейсон А. Л., 1959; Шеклаков Н. Д., 1961]. И лишь в 1791 г. Wichmann I. E. представил описание пузырчатки под названием «pemphigus» и высказал мнение, что пузырчатка всегда является хроническим заболеванием. В статье была представлена история болезни мужчины в возрасте 60 лет с поражением слизистых оболочек полости рта и кожных покровов в виде пузырных высыпаний и эрозий. Спустя 15 месяцев от начала заболевания больной скончался [Шеклаков Н. Д., 1961].
В XVIII и ХIX вв. на протяжении всего периода исследования пузырчатки предлагались различные классификации заболевания [Картамышев А. И., 1966; Шеклаков Н. Д., 1961]. Так, Willan P. (1797) выделял три формы пузырных заболеваний: pemphigus vulgaris, contagiosus и infantum. Немного ранее Plenk I. (1783), предлагая свою классификацию дерматозов, выделял и четвертый класс под названием «пемфигинозное высыпание пузырей». Wilson E. (1808) отмечал только pemphigus acutus, pemphigus chronicus и pemphigus gangrenosus. Таким образом, к началу второй половины ХIX в. существовало до 97 различных форм пузырчатки, выделенных на основании клинико-морфологических признаков заболеваний, основным проявлением которых являлся пузырь [Шеклаков Н. Д., 1961].
В 1844 г. Cazenave P. описал эксфолиативную форму пузырчатки (pemphigus foliaceus). А в 1860 г. Hebra F. выделил две формы истинной пузырчатки: pemphigus vulgaris и pemphigus foliaceus. Hebra F. отмечал, что течение pemphigus foliaceus более тяжелое, сопровождается отслойкой эпидермиса дальше от первоначального очага поражения, обнажая красную, мокнущую поверхность сосочкового слоя дермы, и всегда приводящее к гибели больного. Рemphigus vulgaris, по мнению Hebra F., может сопровождаться полной эпителизацией эрозий, возникших на месте пузырных высыпаний, и в ряде случаев заканчиваться выздоровлением [Картамышев А. И., 1963, 1966].
В 1881 г. Auspitz H. ввел понятие об акантолитических пузырях, главной причиной которых является нарушение прочности эпителия в результате воздействия внутренних или внешних факторов. В своей работе Auspitz H. обратил внимание на локализацию пузырей в мальпигиевом слое, над базальным и под роговым; отсутствие выраженной воспалительной реакции в начале заболевания; выделил заболевания, при которых образование пузырей носило только воспалительный характер [Auspitz H., 1881].
Венская школа, во главе с Hebra F. (1876) и Kaposi M. (1896), не признавала pemphigus acutus как острую форму истинной пузырчатки. Kaposi M. также высказывал мысль о том, что все формы пузырчатки могут трансформироваться одна в другую [Картамышев А. И., 1966; Шеклаков Н. Д., 1961; Hebra F., 1876; Kaposi M., 1896]. Спустя почти два столетия это наблюдение было обосновано и подтверждено иммунологическими исследованиями.
В 1884 г. Duhring L. A. выделил из группы пузырчатки герпетиформный дерматит как самостоятельное заболевание, характеризующееся полиморфизмом сыпи. А в 1886 г. Neumann I. представил описание третьей клинической формы пузырчатки — pemphigus vegetans.
В январе 1894 г. на V съезде русских врачей Никольским П. В. было представлено первое сообщение о механически вызываемом отделении рогового слоя эпидермиса у больных листовидной пузырчаткой (рис. 1.1). Впоследствии феномен механической отслойки эпидермиса как важнейший диагностический признак пузырчатки был впервые им подробно описан в докторской диссертации (1896), а также в его отечественных статьях и за рубежом, в журнале Bul. de la socie’te france de derm. et de syph. (1898).
В 1900 г. на III конгрессе дерматологов в Париже Никольский П. В. продемонстрировал симптом механической отслойки эпидермиса и на видимо неизмененной коже больных, страдающих пузырчаткой.
В своей диссертационной работе и последующих руководствах «Болезни кожи» (1923, 1927, 1930) Никольский П. В. описывал два варианта симптома, характерного для пузырчатки:
Pemphigus foliaceus Cazenavi (описан Казенавом в 1844 г.) характеризуется мало напряженными пузырями с вяло морщинистой покрышкой, слоистыми пузырями и корками, подобными слоеному тесту или облаткам, отсутствием совершенной регенерации эпидермиса на пораженных местах и особенно, по моим наблюдениям, ослаблением связи между слоями эпидермиса (между роговым и зернистым слоем) на всей поверхности кожи, даже в промежутках между пузырями и ссадинами, на участках по виду совершенно здоровых. Это последнее свойство кожи обнаруживается двумя способами: 1) при потягивании за разорванную покрышку пузыря можно удалять роговой покров на далекое пространство, даже на коже по виду совершенно здоровой; 2) при трении здоровой по виду кожи роговой слой легко сходит, обнажая едва влажную поверхность подлежащего (зернистого) слоя. Благодаря тому же свойству, при pemphigus foliaceus получаются ссадины не только на местах разорвавшихся пузырей, как это бывает при pemphigus vulgaris и pemphigus vegetans, но и на таких местах, где никогда не было пузырей, так как достаточно небольшого трения (при движении в постели, при ходьбе, при чесании), чтобы получить большую отслойку рогового покрова. Поэтому при описываемой форме обнажения кожи достигают особенно больших размеров. Ослабление связи между роговым и зернистым слоями нередко удается определить уже в начальном периоде болезни, когда высыпание пузырьков еще самое ничтожное и ограниченное. Поэтому естественно допустить, что именно это свойство кожи является главным изменением, на фоне которого развертывается вся пестрая картина болезни. Описанные формы, по заявлению некоторых авторов, могут переходить одна в другую. Так, pemphigus vulgaris и pemphigus vegetans могут перейти в pemphigus foliaceus.
Последнее явление в последующем нашло иммунопатологическое научное объяснение [Махнева Н. В., Белецкая Л. В., 2012].
Никольский П. В. не только представил описание «механического» симптома при рemphigus foliaceus, но и обосновал этот симптом: «pemphigus вообще имеет своим начальным изменением ослабление связи между пластами эпидермиса, то на ограниченных участках, на которых и образуются пузыри, то, при высшей степени ослабления, по всей поверхности кожи, причем, кроме пузырей и происходящих из них ссадин, образуются ссадины и на участках по виду здоровых, но где роговой пласт уже слабо связан с подлежащею тканью». Ученый считал, что в основе симптома лежит keratolysis universalis.
Не менее важной заслугой Никольского П. В., ставшего одним из основоположников психодерматологии в области изучения пузырчатки, является выявление провоцирующих факторов пузырчатки. В своем исследовании он проследил связь между психическим состоянием больного и течением пузырчатки: «…не всегда бывает малозаметное начало болезни. Иногда, наоборот, оно бывает бурным, что случается, если началу болезни предшествуют какие-либо сильные влияния психические (аффекты) или физические (простуда)».
В 1926 г. Senear F.E. и Usher B. описали синдром, при котором сочетались симптомы красной волчанки и пузырчатки. Новая клиническая форма была названа эритематозной или себорейной пузырчаткой (синдром Сенира — Ашера).
В 1932 г. Павлов С. Т. продемонстрировал, что «явления акантолиза обнаруживаются и на участках совершенно здоровой кожи, что и обуславливает образование на них симптома Никольского» (рис. 1.2) [Павлов С. Т., 1945].
В 1933 г. в немецком журнале «Archiv f. Dermatologie u. Syphilis» Павлов С. Т. опубликовал статью «К вопросу о сущности феномена Никольского при листовидной пузырчатке» («To Essence of Nikolsky’s Phenomenon in Pemphigus Foliaceus») (рис. 1.3). В своей работе Павлов С. Т. впервые описал патогистологическую основу симптома Никольского, представил описание своеобразно измененных клеток шиповатого слоя, получивших в дальнейшем наименование акантолитических. Рассуждения автора о «так называемых акантолитических пузырях», о сущности акантолиза современны и представляют большой интерес. Павлов С. Т. также отметил, что «на основании данных других исследователей и собственных отдельных наблюдений мы можем отметить, что феномен Никольского иногда наблюдается и при других заболеваниях…, в то время как при листовидной пузырчатке эти наблюдения являются правилом».
Методика обнаружения этих клеток, названных акантолитическими клетками, была разработана Tzanck A. и Aron-Brunetiere R. в 1947 г. Акантолитические клетки, которые по имени автора иногда стали называть клетками Тцанка, предлагалось получать с поверхности эрозий с помощью соскоба скальпелем (рис. 1.4).
Отечественные ученые Краскина Н. А. и Строд А. К. (1955) впервые применили более удобное и менее травматичное взятие материала для цитологического исследования с помощью мазков-отпечатков со дна пузырей и эрозий предметным стеклом. Впервые взятие мазков-отпечатков предметным стеклом использовали в 1942 г. отечественные ученые Покровская М. П., Макаров М. С. при цитологическом исследовании раневой поверхности. Шеклаков Н. Д. (1958) впервые применил стерильный ластик для взятия материала со дна эрозий при пузырчатке.
Шеклаков Н. Д. (1960) выделил три фазы в клиническом течении пузырчатки и в зависимости от фазы ее клинического течения предложил цитологическую диагностику заболевания [Машкиллейсон Л. Н., 1964; Памяти Шеклакова, 1990]. Согласно исследованиям Шеклакова Н. Д. в начальной фазе, предшествующей рецидиву после ремиссии, при цитологическом исследовании преобладают неизмененные эпителиальные клетки, но обнаруживаются и клетки с крупными ядрами и небольшим количеством цитоплазмы (так называемые переходные формы). У большинства больных также обнаруживаются одиночные акантолитические клетки или их небольшие скопления. В фазе рецидива появляются сплошные «пласты», состоящие из акантолитических клеток; наблюдаются гигантские акантолитические клетки, «чудовищные» и многоядерные. В период преимущественной эпителизации количество акантолитических клеток уменьшается, отсутствуют «чудовищные» и многоядерные клетки, появляются переходные формы и клетки нормального эпителия.
На V Всесоюзном съезде дерматовенерологов (1959) Павлов С. Т. и Самцов В. И. представили глубокий анализ клинических форм пузырчатки: «не подлежит сомнению, что центральным звеном всей группы буллезных дерматозов являются те заболевания, которые издавна, исторически, принято называть пузырчаткой в трех ее разновидностях: вульгарной, вегетирующей и листовидной. Общность этих трех форм, вследствие перехода одной в другую, одинаковой морфологической основы и ряда других признаков…, ни у кого не вызывает сомнений». Авторами были обоснованы общие признаки различных клинических форм пузырчатки: «общими данными, характеризующими все три формы пузырчатки, являются: 1) Мономорфность буллезного поражения кожи с последующим развитием лишь эволюционного полиморфизма. 2) Интраэпителиальное расположение полости пузырей, образующихся вследствие явлений акантолиза. Последний устанавливается путем гистологического исследования биопсированных свежих пузырей или путем цитодиагностики по Тцанку… 3) Третьей особенностью, присущей всем трем формам пузырчатки, является исключительно плохой прогноз…»
При детальном анализе различных форм пузырчатки Павлов С. Т. и Самцов В. И. отметили, что при вульгарной пузырчатке симптом Никольского «выявляется …обычно не в начальном периоде, а лишь в периоде полного развития заболевания», а при синдроме Сенира — Ашера — «непостоянно и своеобразно». В своем труде ученые подтвердили обнаружение акантолиза на участках видимо здоровой кожи при рemphigus foliaceus, который обуславливает симптом Никольского; сопоставили гистологические и цитологические исследования. Авторами было высказано и обосновано предположение, что синдром Сенира — Ашера (себорейная, или эритематозная, пузырчатка) является «своеобразной абортивной формой листовидной пузырчатки». В настоящее время это предположение подтверждено исследованиями на уровне десмоглеинов и себорейная, или эритематозная, пузырчатка рассматривается как малая форма листовидной [Amagai M. et al., 1999, 2000; Amagai M., 2002; Challacombe S. J. et al., 2001; Jamora M. J. et al., 2003] (рис. 1.5).
На V Всесоюзном съезде дерматовенерологов было высказано предположение о роли вирусов в возникновении пузырчатки [Акопян А. Т., 1961; Щербаков И. М., 1961]. Однако до сегодняшнего дня это предположение не получило четкого обоснования.
Asbo-Hansen G. (1960) представил описание симптома при пузырчатке, суть которого заключается в увеличении площади пузыря при надавливании на его невскрывшуюся покрышку. Симптом не является патогномоничным для истинной пузырчатки и вызывается как при внутриэпидермальном расположении пузырей, так и при субэпидермальной их локализации. Ученый наблюдал его при пузырчатке, буллезном пемфигоиде Левера, лекарственной буллезной экзантеме и эмболической гангрене.
В стадии обострения пузырчатки крупные пузыри под тяжестью экссудата могут принимать грушевидную форму, «симптом груши», который описал Шеклаков Н. Д. в 1961 г. [Торсуев Н. А. с соавт., 1979] (рис. 1.6).
Очевидно, что клинические, цитологические и гистологические изменения не всегда позволяют выставить окончательный диагноз при пузырчатке. В связи с этим актуальным при постановке диагноза пузырчатки является метод флюоресцирующих антител. Метод флюоресцирующих антител, предложенный в 1950 г. Coons А. и Kaplan M., нашел широкое применение в науке и практике [Coons A., Kaplan M., 1950; Weller T. H., Coons A. H., 1954]. В дерматологии основные исследования проводились при эритематозе, склеродермии, пузырчатке, буллезном пемфигоиде [Бутов Ю. С. с соавт., 1974; Ребрик М. С. с соавт., 1973; Серов В. В. с соавт., 1972; Трофимова Л. Я., Киселева М. Л., 1973; Шапошников О. К. с соавт., 1972; Ablin R. J., 1969; Ablin R. J., Beutner E. H., 1969; Ablin R. J. et al., 1969; Beutner E. H., 1968; Cormane R. H., 1964].
При пузырчатке непрямым методом иммунофлюоресценции Beutner E. H. и Jordon R. E. (1964) в сыворотке больных вульгарной пузырчаткой обнаружили антитела, направленные к антигенным компонентам межклеточной склеивающей субстанции шиповатого слоя. Это наблюдение позволило предположить аутоиммунный механизм развития пузырчатки, определить диагностическую и прогностическую ценность этого метода. Дальнейшие научные исследования подтвердили это предположение [Beutner E. H. et al., 1965; Beutner E. H., 1968; Chorzelski T. P. et al., 1966]. Среди первых отечественных исследователей, применивших в работе методы иммунофлюоресценции, были Романенко Г. Ф., Белецкая Л. В. и Ежов Н. Я. (1973—1977). Ими представлена не только оценка и безусловная диагностическая ценность прямого и непрямого методов иммунофлюоресценции, но и место, которое занимают эти методы в дифференциальной диагностике аутоиммунной пузырчатки с другими буллезными дерматозами. В работах Белецкой Л. В. и Гнездицкой Э. В. (1974) продемонстрирована высокая тканевая специфичность циркулирующих аутоантител к антигенам межклеточной склеивающей субстанции не только многослойного плоского эпителия, но и эпителия телец Гассаля тимуса человека и животных. В настоящее время диагностическая и прогностическая ценность методов (прямой и непрямой) иммунофлюоресценции не подвергается сомнению [Махнева Н. В., Белецкая Л. В., 2010; Фицпатрик Т. с соавт., 1999].
На следующий год после публикации Beutner E. H. и Jordon R. E. в 1965 г. Witebsky E. разработал признаки аутоиммунных заболеваний: 1. Обнаружение в сыворотке циркулирующих антител или фиксированных в тканях антител; 2. Наличие специфического антигена, к которому направлены эти антитела; 3. Получение антител к этому антигену в эксперименте; 4. Обнаружение патологических изменений соответствующей ткани активно сенсибилизированного животного, сходных или идентичных изменениям при заболевании человека.
Таким образом, аутоиммунный механизм развития пузырчатки был определен окончательно и начался новый, «иммунологический» этап в исследовании патогенеза пузырчатки.
Согласно современным исследованиям уровень акантолиза при различных формах истинной (аутоиммунной) пузырчатки объясняется расположением десмоглеинов 1 и 3 в эпидермисе кожи и эпителии слизистой оболочки полости рта [Amagai M. et al., 1999; Challacombe S. J. et al., 2001; Jamora M. J. et al., 2003; Maruani A. et al., 2008].
Amagai М. (2002) предложил десмоглеин-компенсаторную теорию образования пузырей при пузырчатке, объясняющую клинические особенности различных форм заболевания с учетом расположения десмоглеинов 1 и 3 в эпидермисе кожи и эпителии слизистой оболочки полости рта (см. рис. 1.5).
Lanza A. и соавт. (2007) показали, что сывороточные антитела к десмоглеину 1 препятствуют образованию новых десмосом, а не напрямую нарушают десмоглеин 1 содержащие связи, когда стабильные контакты уже сформированы.
В конце 90-х гг. прошлого столетия активно началось исследование генетической предрасположенности к истинной (аутоиммунной) пузырчатке, так как было отмечено повышение частоты заболеваемости у жителей Средиземноморья, преимущественно у евреев ашкенази [Mutasim D. F. et al., 2005]. В настоящее время вопрос о связи истинной пузырчатки с определенными антигенами гистосовместимости не подвергается сомнению. Однако исследования, проведенные в разных странах, демонстрируют различные результаты [Bordel-Gómez M. T. et al., 2006; Lombardi M. L. et al., 1999; Miyagawa S. et al., 2002]. Классификация пузырчатки и описание новых ее клинических форм продолжается на протяжении всей истории развития болезни.
Предположение связи синдрома Сенира — Ашера со злокачественными опухолями высказывал еще Tzanck A. в 1947 г. при описании методики цитологического исследования. Однако клинически обосновали его предположение Н. С. Потекаев и соавт. (1964) в статье «Злокачественные новообразования и везикуло-буллезные дерматозы», и не только в отношении синдрома Сенира — Ашера, но и других форм пузырчатки. Аnhalt G. J. и соавт. (1990) на основании клинико-патоморфологических и гистохимических исследований выделили паранеопластическую пузырчатку как особую форму пузырчатки.
В 1975 г. Jablonska S. и соавт. представили описание герпетиформной пузырчатки. В 80—90-е гг. прошлого столетия в группу аутоиммунной пузырчатки были включены IgA-зависимая пузырчатка и нейтрофильный IgA-зависимый дерматоз [Robinson N. D. et al., 1999]. Лекарственно-индуцированная пузырчатка была выделена в самостоятельную группу, так как было установлено, что провоцирующими факторами данной формы пузырчатки могут являться D-пеницилламин, а также каптоприл, фуросемид, фенацетин, пенициллин, тиопронин и препараты сульфонового ряда, например дапсон [Махнева Н. В. с соавт., 2004; Maruani A. et al., 2008].
До середины XX в. все случаи истинной пузырчатки заканчивались летальным исходом. Так, Брауде Р. С. и Лейбман В. И. (1953) на основании изучения материала больницы им. Т. В. Короленко за 20 лет пришли к выводу, что больные пузырчаткой погибали в сроки от 1,5 месяцев до 2 лет. Новая эра в лечении пузырчатки началась 9.05.1950, когда Newman B. A. и Feldman F. сделали сообщение на заседании Лос-Анджелесского дерматологического общества об успешном лечении больного вегетирующей пузырчаткой кортизоном. В июне того же года Thorn G. W. и соавт. использовали в терапии больного вульгарной пузырчаткой адренокортикотропный гормон (кортикотропин) и кортизон. В отечественной литературе первые сообщения об успешном применении адренокортикотропного гормона и кортизона принадлежали Гринчару Ф. Н. и Егоровой Л. Е. (1955); Колоколовой Н. Н. и Шараповой Г. Я. (1955). Однако широкого распространения лечение больных адренокортикотропным гормоном не получило. В 1950—60-х гг. появилось немало сообщений о высокой терапевтической активности преднизолона и преднизона по сравнению с кортизоном и адренокортикотропным гормоном [Demartini F. et al., 1955; Miller J. L., 1956; Philipp A., 1956; Rein C. R., Bodian E. L., 1956; Robinson H. M., 1955]. Первыми в отечественной медицине успешные результаты лечения истинной пузырчатки преднизолоном опубликовали Пер М. И. и Машкиллейсон А. Л. (1958) (рис. 1.7). Однако вопросы о максимальной терапевтической дозе преднизолона, снижении средних и малых доз до поддерживающей дозы системных глюкокортикостероидов остаются до сих пор дискутабельными.
Итак, на протяжении всего периода существования человека пузырчатка остается одним из загадочных заболеваний, к которому до сегодняшнего дня не ослабевает интерес ученых, исследователей и клиницистов всех стран мира.
Иллюстративный материал
Рисунок 1.1. Никольский П. В. (1858—1940), заведующий кафедрой дерматовенерологии медицинского факультета университета в г. Ростов-на-Дону, д. м. н., профессор.

Рисунок 1.2. Павлов С. Т. (1897—1971), начальник кафедры кожных и венерических болезней Военно-медицинской академии (1940—1968), член-корреспондент АМН СССР (1950), генерал-майор медицинской службы, д. м. н., профессор.

Рисунок 1.3. Статья Павлова С. Т. в журнале «Archiv f. Dermatologie u. Syphilis»: первая страница статьи (а) и рисунок, объясняющий явление акантолиза (b).

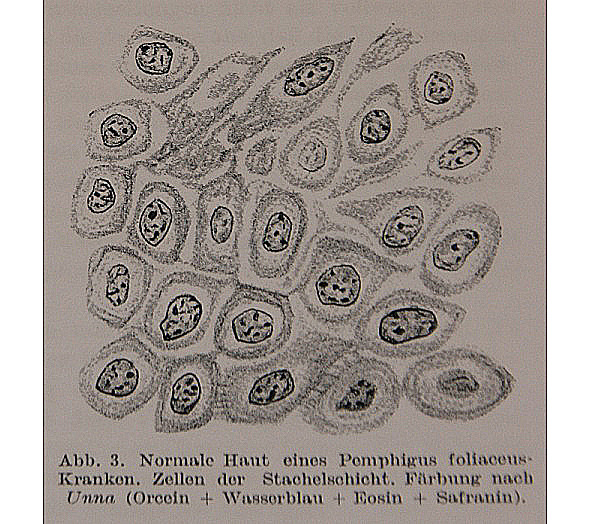

Рисунок 1.4. Рисунок Tzanck A. Схематическое изображение уровней образования пузырей при пузырчатке и герпетиформном дерматите Дюринга.
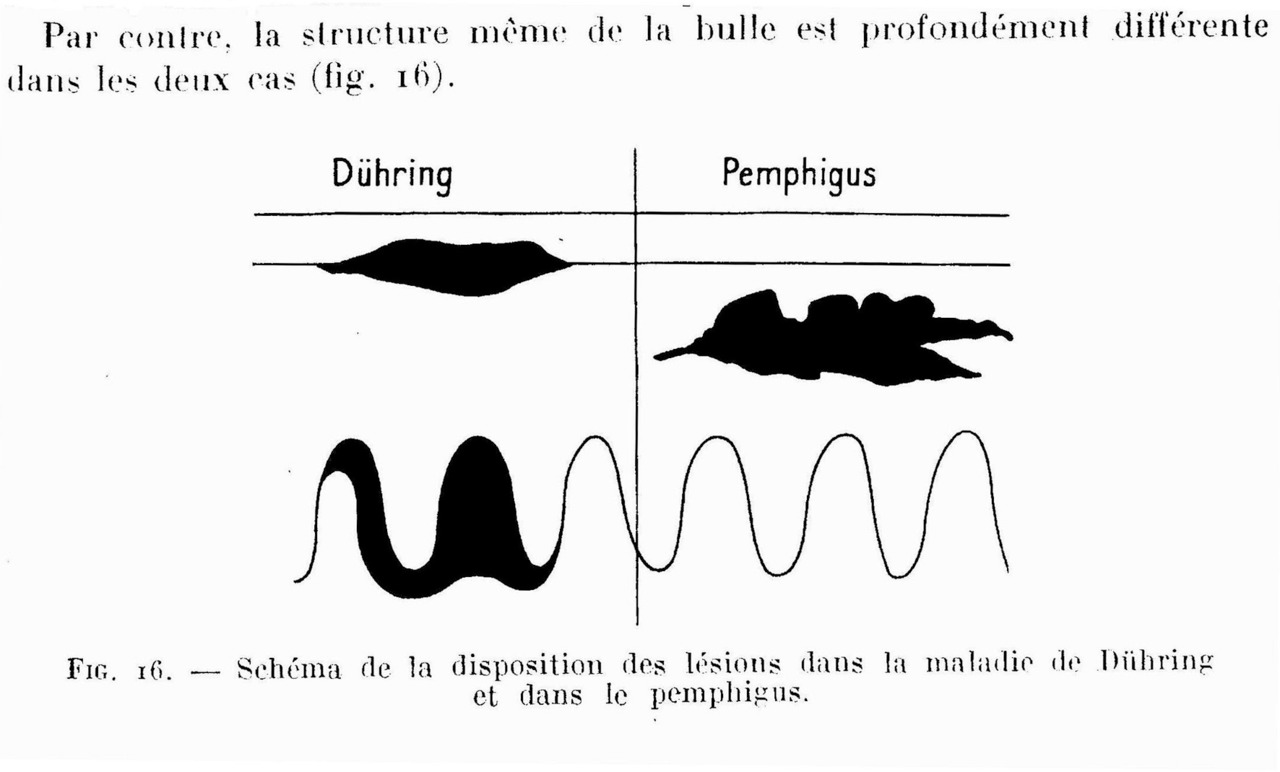

Рисунок 1.5. Рисунок Amagai M. (2002), объясняющий десмоглеин-компенсаторную теорию образования пузырей при пузырчатке.
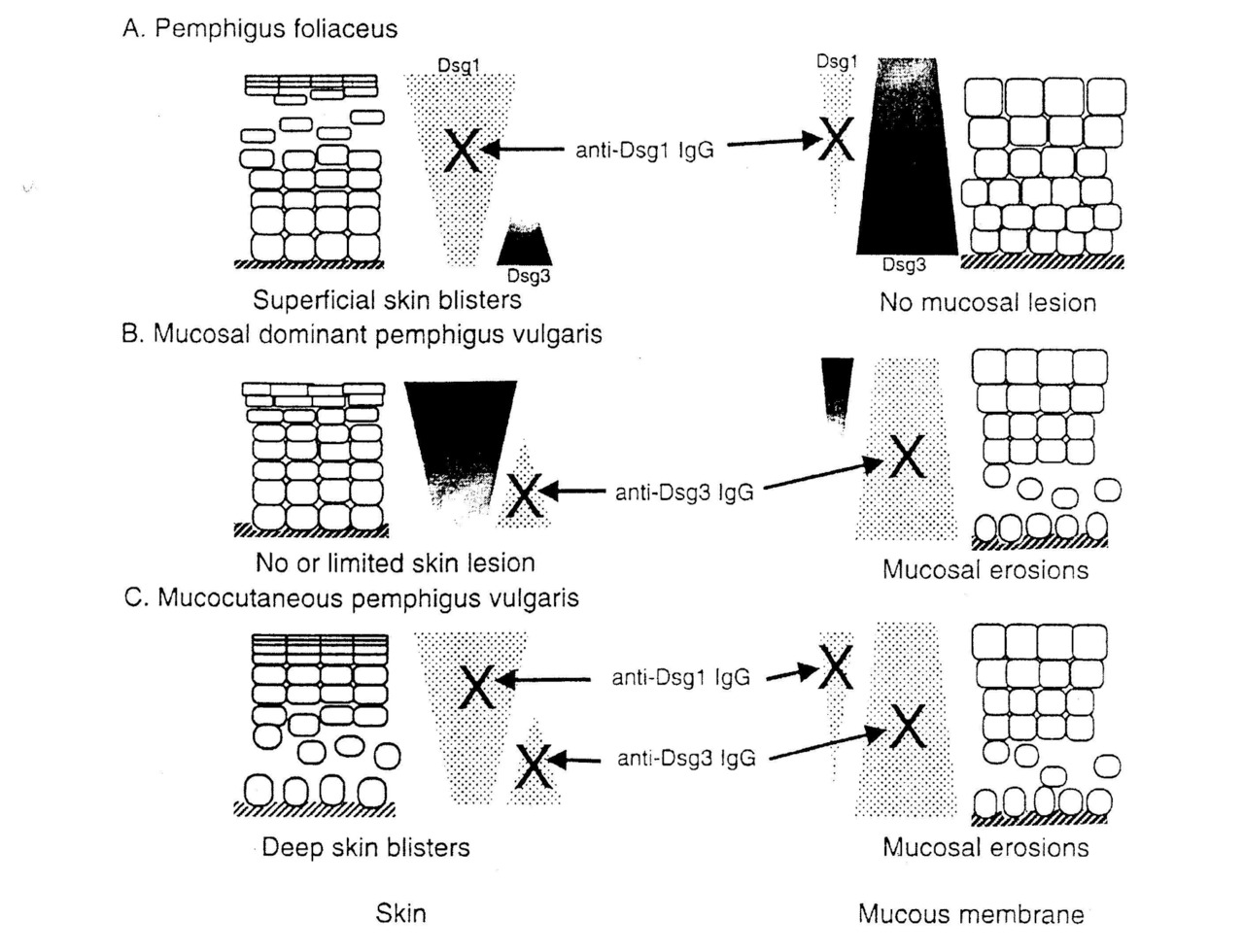

Рисунок 1.6. Шеклаков Н. Д. (1918—1990), заведующий отделом микологии Центрального кожно-венерологического института, д. м. н., профессор.


Рисунок 1.7. Машкиллейсон А. Л. (1928—1997), заведующий кафедрой кожных и венерических болезней Московского медицинского стоматологического института, член-корреспондент Российской академии естественных наук, д. м. н., профессор.

Библиография
Акопян А. Т. Материалы по изучению этиологии пузырчатки // Труды V Всесоюзного съезда дерматовенерологов. — Л.: Медгиз, 1961. — С. 111—114.
Белецкая Л. В., Гнездицкая Э. В. Реакция сывороток больных вульгарной пузырчаткой с антигенами склеивающей субстанции эпителия телец Гассаля тимуса человека и животных // Бюллетень экспериментальной биологии и медицины. — 1974. — №6. — С. 87—90.
Брауде Р. С., Лейбман В. И. Материалы к изучению пузырчатки // Актуальные вопросы дерматовенерологии. — М., 1953. — С. 91—96.
Бутов Ю. С., Скрипкин Ю. К., Кошевенко Ю. Н., Стефани Д. В. Материалы по изучению сывороточных и тканевых иммуноглобулинов при некоторых дерматозах // Вестник дерматологии и венерологии. — 1974. — №10. — C. 8—15.
Глухенький Б. Т., Грандо С. А., Коляденко В. Г., Степаненко В. И., Глухенькая А. Б. История и клиническое значение симптома Никольского в диагностике пузырных дерматозов // Украiн. журн. дерматол., венерол., косметол. — 2003. — №4. — С. 6—12.
Гринчар Ф. Н., Егорова Л. Е. Пемфигус полости рта, леченный кортизоном // Вестник дерматологии и венерологии. — 1955. — №2. — С. 42—44.
Ежов Н. Я. Клинические и иммуноморфологические исследования больных пузырчаткой в процессе лечения кортикостероидными гормонами и метотрексатом: автореферат дис. … канд. мед. наук. — М., 1974.
Картамышев А. И. Пузырчатые дерматозы. — М., 1963. — С. 3—39.
Картамышев А. И. Пузырчатые дерматозы. — М., 1966. — С. 3—80.
Колоколова Н. Н., Шарапова Г. Я. Лечение больных пузырчаткой кортизоном и адренокортикотропным гормоном // Вестник дерматологии и венерологии. — 1955. — №2. — С. 44—48.
Краскина Н. А., Строд А. К. Диагностическое значение цитологической картины в очагах поражения при пузырчатке // Вестник дерматологии и венерологии. — 1955. — №5. — С. 10—14.
Мансуров Н. П. Накожные болезни. — М., 1863. — 961 с.
Махнева Н. В., Молочков В. А., Белецкая Л. В. Медикаментозная пузырчатка // Российский журнал кожных и венерических болезней. — 2004. — №3. — С. 14—18.
Махнева Н. В., Белецкая Л. В. Иммунофлюоресценция в клинике аутоиммунных буллезных дерматозов: пособие для врачей. — М.: Академия Естествознания, 2010. — 44 с.
Махнева Н. В., Белецкая Л. В. Иммунопатологические аспекты аутоиммунных буллезных дерматозов. — Palmarium Academic Publishing, 2012. — 416 с.
Машкиллейсон А. Л. К истории и номенклатуре пемфигуса // Сборник научных работ по лепрологии и дерматологии. — Ростов н/Д., 1959. — №12. — С. 133—137.
Никольский П. В. Случай pemphigus foliaceus Cazenavi // Труды V съезда русских врачей в память Н. И. Пирогова. — СПб., 1894. — Т. II. — С. 217.
Никольский П. В. Болезни кожи: руководство для врачей и студентов. — М.: Госиздат, 1928. — С. 154—166.
Павлов С. Т. К вопросу о начальных изменениях кожи при пузырчатке // Научные работы ленинградских дерматовенерологов за годы отечественной войны. — Л., 1945. — Т. 4. — С. 61—64.
Павлов С. Т., Самцов В. И. Классификация и дифференциальный диагноз буллезных поражений кожи // Труды V Всесоюзного съезда дерматовенерологов. — Л.: Медгиз, 1961. — С. 103—110.
Павлов С. Т. К вопросу о сущности феномена Никольского при листовидной пузырчатке / пер. с нем. А. Н. Львова // Клиническая дерматология и венерология. — 2003. — №2. — С. 78—82.
Памяти проф. Н. Д. Шеклакова. Некролог // Вестник дерматологии и венерологии. — 1990. — №11. — C. 80.
Пер М. И., Машкиллейсон А. Л. Лечение больных пузырчаткой кортизоном и другими кортикальными стероидами // Советская медицина. — 1958. — №8. — С. 102—108.
Покровская М. П., Макаров М. С. Цитология раневого экссудата как показатель процесса заживления ран. — М.: Наркомздрав СССР «Медгиз», 1942.
Потекаев Н. С., Кечкер В. И., Николаева Л. П. Злокачественные новообразования и буллезные дерматозы // Гистохимические и биохимические исследования в дерматологии. Труды 1 ММИ. — М., 1964. — Т. 31. — С. 227—232.
Потекаев Н. С., Махнева Н. В., Теплюк Н. П. К истории истинной акантолитической пузырчатки // Клиническая дерматология и венерология. — 2012. — №5. — С. 98—105.
Ребрик М. С., Пашков Б. М., Белецкая Л. В. Иммунофлюоресцентные исследования при доброкачественной неакантолитической пузырчатке слизистой оболочки полости рта // Вестник дерматологии и венерологии. — 1973. — №7. — С. 26—30.
Руководство по дерматовенерологии / под ред. Л. Н. Машкиллейсона. — М.: Медицина, 1964. — Т. 3. — С. 286—324.
Серов В. В., Насонова В. А., Варшавский В. А. Иммунологическая характеристика изменений кожи при красной волчанке // Советская медицина. –1972. — №9. — С. 15—19.
Торсуев Н. А. П. В. Никольский — М.: Государственное издательство медицинской литературы, 1953. — 168 c.
Торсуев Н. А., Шеклаков Н. Д., Романенко В. Н. Буллезные дерматозы. — М.: Медицина, 1979. — С. 9—11.
Трофимова Л. Я., Киселева М. Л. Значение иммунофлуоресцентного метода в диагностике красной волчанки // Вестник дерматологии и венерологии. — 1973. — №8. — С. 82—85.
Фицпатрик Т., Джонсон Р., Вулф К., Полано М., Сюрмонд Д. Дерматология: атлас-справочник. — М.: Практика, 1999. — С. 409—413.
Шапошников О. К., Домасева Т. В., Тульчинский А. А., Зубжицкий Ю. Н. Опыт изучения иммунологических показателей при сосудистых заболеваниях кожи // Вестник дерматологии и венерологии. — 1972. — №12. — С. 34—39.
Шеклаков Н. Д. Диагностическая ценность цитологических исследований при пузырных и пузырьковых поражениях полости рта // Советская медицина. — 1958. — №4. — С. 30—36.
Шеклаков Н. Д. О фазовости течения пузырчатки и оценке результатов цитологических исследований // Вестник дерматологии и венерологии. — 1960. — №4. — С. 21—24.
Шеклаков Н. Д. Пузырчатка. — М.: Медгиз, 1961. — С. 10—13.
Щербаков И. М. Исследование этиологии заболеваний из группы пузырчатки // Материалы по изучению этиологии пузырчатки. Труды V Всесоюзного съезда дерматовенерологов. — Л.: Медгиз, 1961. — С. 115—116.
Ablin R. J. Immunopathologic studies of experimental pemphigus-like autoantibodies and bullous-like lesions // J. Invest. Dermatol. — 1969. — Vol. 53. — №6. — P. 463—469.
Ablin R. J., Beutner E. H. Experimental production of pemphigus-like antibodies // Clin. Exp. Immunol. — 1969. — Vol. 4. — №3. — P. 283—291.
Ablin R. J., Milgrom F., Kano K., Rapaport F. T., Beutner E. H. Pemphigus‐like antibodies in patients with skin burns // Vox Sang. — 1969. — Vol. 16. — №1. — P. 73—75.
Amagai M., Tsunoda K., Zillikens D., Nagai T., Nishikawa T. The clinical phenotype of pemphigus is defined by the anti-desmoglein autoantibody profile // J. Am. Acad. Dermatol. — 1999. — Vol. 40. — №2. — P. 167—170.
Amagai M., Tsunoda K., Suzuki H., Nishifuji K., Koyasu S., Nishikawa T. Use of autoantigen-knockout mice in developing an active autoimmune disease model for pemphigus // J. Clin. Invest. — 2000. — Vol. 105. — №5. — P. 625—631.
Amagai M. Pemphigus as a paradigm of autoimmunity and cell adhesion // Keio J. Med. — 2002. — Vol. 51. — №3. — P. 133—139.
Anhalt G. J., Kim S. C., Stanley J. R., Korman N. J., Jabs D. A., Kory M., Izumi H., Ratrie H. 3rd, Mutasim D., Ariss-Abdo L., Labib R. S. Paraneoplastic pemphigus: an autoimmune mucocutaneous disease associated with neoplasia // N. Engl. J. Med. — 1990. — Vol. 323. — №25. — P. 1729—1735.
Asboe-Hansen G. Blister-spread induced by finger-pressure, a diagnostic sign in pemphigus // J. Invest. Dermatol. — 1960. — Vol. 34. — №1. — P. 5—9.
Auspitz H. System der Hautkrankheiten // Allgemeine Pathologie und Therapie der Haut. — 1881. — P. 210—545.
Beutner E. H., Jordon R. E. Demonstration of skin antibodies in sera of pemphigus vulgaris patients by indirect immunofluorescent staining // Proc. Soc. Exp. Biol. Med. — 1964. — Vol. 117. — №2. — P. 505—510.
Beutner E. H., Lever W. F., Witebsky E., Jordon R., Chertock B. Autoantibodies in pemphigus vulgaris: response to an intercellular substance of epidermis // JAMA. — 1965. — Vol. 192. — №8. — P. 682—688.
Beutner E. H. Principles of defined immunofluorescent staining and their application to studies of pemphigus antibodies // Int. Convoc. on Immunol. Buffalo. — 1968. — P. 323—330.
Bordel-Gómez M. T. Sánchez-Estella J., Yuste-Chaves M., Santos-Durán J. C., Alonso-San Pablo M. T. [Familial pemphigus vulgaris: immunogenetic study of HLA class II antigens] // Actas dermosifiliogr. — 2006. — Vol. 97. — №8. — P. 509—513.
Challacombe S. J., Setterfield J., Shirlaw P., Harman K., Scully C., Black M. M. Immunodiagnosis of pemphigus and mucous membrane pemphigoid // Acta Odontol. Scand. — 2001. — Vol. 59. — №4. — P. 226—234.
Chorzelski T. P., von Weiss J. F., Lever W. F. Autoimmunity in pemphigus // Pathol. Europ. — 1966. — Vol. 1. — №1. — P. 268—272.
Chorzelski T. P., von Weiss J. F., Lever W. F. Clinical significance of autoantibodies in pemphigus // Arch. Dermatol. — 1966. — Vol. 93. — №5. — P. 570—576.
Coons A. H., Kaplan M. H. Localization of antigen in tissue cells II. Improvements in a method for the detection of antigen by means of fluorescent antibody // J. Exp. Med. — 1950. — Vol. 91. — №1. — P. 1—13.
Cormane R. H. «Bound» globulin in the skin of patients with chronic discoid lupus erythematosus and systemic lupus erythematosus // Lancet. — 1964. — Vol. 283. — №7332. — P. 534—535.
Demartini F., Boots R. H., Snyder A. I., Sandson J., Ragan C. Comparative effects of prednisone and cortisone // JAMA. — 1955. — Vol. 158. — №17. — P. 1505—1508.
Hebra F. Руководство по изучению болезней кожи (русский перевод). СПб., 1876.
Jablonska S., Chorzelski T. P., Beutner E. H., Chorzelska J. Herpetiform pemphigus, a variable pattern of pemphigus // Int. J. Dermatol. — 1975. — Vol. 14. — №5. — P. 353—359.
Jamora M. J. J., Jiao D., Bystryn J.-C. Antibodies to desmoglein 1 and 3, and the clinical phenotype of pemphigus vulgaris // J. Am. Acad. Dermatol. — 2003. — Vol. 48. — №6. — P. 976—977.
Kaposi M. Ữber den gegenwärtigen Stand der Lehre vom Pemphigus // Arch. f. Dermat. u. Syph. — 1896. — 34. — P. 89—92.
Lanza A., De Rosa A., Femiano F., Annese P., Ruocco E., Gombos F., Lanza M. Cirillo N. Internalization of non-clustered desmoglein 1 without depletion of desmoglein 1 from adhesion complexes in an experimental model of the autoimmune disease pemphigus foliaceus // Int. J. Immunopathol. Pharmacol. — 2007. — Vol. 20. — №2. — P. 355—361.
Lombardi M. L., Mercuro O., Ruocco V., Lo Schiavo A., Lombari V., Guerrera V., Pirozzi G., Manzo C. Common human leukocyte antigen alleles in pemphigus vulgaris and pemphigus foliaceus Italian patients // J. Invest. Dermatol. — 1999. — Vol. 113. — №1. — P. 107—110.
Maruani A., Machet M. C., Carlotti A., Giraudeau B., Vaillant L., Machet L. Immunostaining with antibodies to desmoglein provides the diagnosis of drug-induced pemphigus and allows prediction of outcome // Am. J. Clin. Pathol. — 2008. — Vol. 130. — №3. — P. 369—374.
Miller J. L. Senear-Usher pemphigus // Arch. Dermatol. — 1956. — Vol. 73. — №3. — P. 300—301.
Miyagawa S., Niizeki H., Yamashina Y., Kaneshige T. Genotyping for HLA‐A, B and C alleles in Japanese patients with pemphigus: prevalence of Asian alleles of the HLA‐B15 family // Br. J. Dermatol. — 2002. — Vol. 146. — №1. — P. 52—58.
Mutasim D. F., Bilic M., Hawayek L. H., Pipitone M. A., Sluzevich J. C. Immunobullous diseases // J. Am. Acad. Dermatol. — 2005. — Vol. 52. — №6. — P. 1029—1043.
Newman B. A., Feldman F. Pemphigus vegetans: involution with cortisone therapy // AMA Arch. Derm. — 1951. — Vol. 64. — №1. — P. 105.
Philipp A. Prednisolon (Decortin) in der Behandlung liniger akyter und chronischer Dermatosen // Med. Klin. — 1956. — Vol. 51. — №43. — P. 1820—1822.
Rein C. R., Bodian E. L. A clinical evaluation of prednisone in the treatment of dermatoses // AMA Arch. Derm. — 1956. — Vol. 73. — №4. — P. 378—381.
Robinson H. M. Prednisone in treatment of selected dermatoses: preliminary report // JAMA. — 1955. — Vol. 158. — №6. — P. 473—475.
Robinson N. D., Hashimoto T., Amagai M., Chan L. S. The new pemphigus variants // J. Am. Acad. Dermatol. — 1999. — Vol. 40. — №5. — P. 649—671.
Thorn G. W., Forsham P. H., Frawley T. F., Hill S. R. Jr., Roche M., Staehelin D., Wilson D. L. The clinical usefulness of ACTH and cortisone // N. Engl. J. Med. — 1950. — Vol. 242. — №22. — P. 865—772.
Tzanck A. Le cyto-diagnostic immédiat en dermatologie // Ann. Dermatol. Syphiligr. — 1947. — Vol. 7. — №2. — P. 68.
Tzanck A., Aron-Brunetiere R. [Immediate cytodiagnosis of bullous dermatoses] // Gaz. Med. Port. — 1949. — Vol. 2. — №3. — P. 667—675.
Tzanck A., Aron-Brunetiere R. Le cyto-diagnostic immédiat. // Sem. Hop. — 1949. — Vol. 25. — №95. — P. 3973—3981.
Weller T. H., Coons A. H. Fluorescent antibody studies with agents of varicella and herpes zoster propagated in vitro // Proc. Soc. Exp. Biol. Med. — 1954. — Vol. 86. — №4. — P. 789—794.
Witebsky E. Organ-specific antibodies // Ann. N.Y. Acad. Sci. — 1965. — Vol. 124. — №1. — P. 29—36.
Глава 2.
Классификация аутоиммунной пузырчатки
Аутоиммунная пузырчатка — достаточно редкое аутоиммунное заболевание (наряду с миастенией и аутоиммунными анемиями) кожи и слизистых оболочек, выстланных многослойным плоским эпителием, при котором патогенетическая роль принадлежит циркулирующим аутоантителам, направленным против антигенов десмосом (межклеточной связывающей субстанции) или кератиноцитов [Махнева Н. В., Белецкая Л. В., 2012; Разнатовский И. М. с соавт., 1995; Beutner E.H. et al., 1973; Thivolet J., 1993, 1994]. Она включает группу жизнеугрожающих аутоиммунных буллезных дерматозов, характеризующихся внутриэпителиальным образованием пузырей (табл. 2.1).
Таблица 2.1. Классификация аутоиммунной пузырчатки по патогистологическим признакам ([Eming R. and Hertl M., 2006], с изменениями)

По уровню расположения этих пузырей различают группу вульгарной пузырчатки, при которой пузыри располагаются на уровне базального слоя, и группу листовидной пузырчатки с внутриэпидермальным расположением пузырей на уровне зернистого слоя [Пальцев М. А. с соавт., 2004; Цветкова Г. М. с соавт., 2003; Becker B. A., Gaspari A. A., 1993; Bickle K. et al., 2002; Bystryn J.-C., Rudolph J. L., 2005]. За последние годы в самостоятельную форму выделены паранеопластическая пузырчатка, которая манифестирует при неоплазии, лекарственно-индуцированная пузырчатка, возникающая обычно после применения пеницилламина, и IgA-зависимая пузырчатка, при которой патогенетическая роль принадлежит циркулирующим IgA-аутоантителам [Самцов А. В., Белоусова И. Э., 2004; Теплюк Н. П., 2006; Billet S. E. et al., 2006; Camisa C. et al., 1992; Cartee T. V., Swerlick R. A., 2008; Hertl M., 2005; Seidenbaum M., Katz M., 1987].
Внедрение молекулярно-биологических исследований в практическую медицину, способствуя более глубокому изучению патогенеза буллезных дерматозов, позволяет не только выявить особенности ассоциации клинической картины с данными гистопатологических и молекулярно-биологических исследований, но и упорядочить полученные знания с целью усовершенствования классификации данной группы аутоиммунных буллезных дерматозов.
Библиография
Махнева Н. В., Белецкая Л. В. Иммунопатологические аспекты аутоиммунных буллезных дерматозов. — Palmarium Academic Publishing, 2012. — 416 с.
Пальцев М. А., Потекаев Н. Н., Казанцева И. А., Лысенко А. И., Лысенко Л. В., Червонная Л. В. Клинико-морфологическая диагностика заболеваний кожи: атлас. — М.: Медицина, 2004. — 428 с.
Разнатовский И. М., Белецкая Л. В., Петрова И. В. Общая гистопатология и иммунопатология кожи // Кожные и венерические болезни: руководство для врачей / под ред. Ю. К. Скрипкина. — М.: Медицина, 1995. — Т.1. — С. 71—122.
Самцов А. В., Белоусова И. Э. Паранеопластическая пузырчатка, индуцированная саркомой из фолликулярных дендритических клеток, возникшей на фоне опухоли Кастлемана // Вестник дерматологии и венерологии. — 2004. — №1. — С. 37—39.
Теплюк Н. П. Истинная пузырчатка и буллезный пемфигоид как паранеопластические процессы // Альманах клинической медицины. — 2006. — Т. IX. — С. 134—136.
Цветкова Г. М., Мордовцева В. В., Вавилов А. М., Мордовцев В. Н. Патоморфология болезней кожи. — М.: Медицина, 2003. — 496 с.
Becker B. A., Gaspari A. A. Pemphigus vulgaris and vegetans // Dermatol. Clin. — 1993. — Vol. 11. — №3. — P. 429—452.
Beutner E. H., Chorzelski T. P., Bean S. F., Jordon R. E. Immunopathology of the Skin: Labeled Antibody Studies // Hutchinson and Ross, Straudsburg, Pa, Dowden. — 1973. — 461 p.
Bickle K. M., Roark T. R., Hsu S. Autoimmune bullous dermatoses: a review // Am. Fam. Physician. — 2002. — Vol. 65. — №9. — P. 1861—1870.
Billet S. E., Grando S. A., Pittelkow M. R. Paraneoplastic autoimmune multiorgan syndrome: review of the literature and support for a cytotoxic role in pathogenesis // Autoimmunity. — 2006. — Vol. 39. — №7. — P. 617—630.
Bystryn J.-C., Rudolph J. L. Pemphigus // Lancent. — 2005. — Vol. 366. — №9479. — P. 61—73.
Camisa C., Helm T. N., Liu Y. C., Valenzuela R., Allen C., Bona S., Larrimer N., Korman N. J. Paraneoplastic pemphigus: a report of three cases including one long-term survivor // J. Am. Acad. Dermatol. — 1992. — Vol. 27. — №4. — P. 547—553.
Cartee T. V., Swerlick R. A. Immunoglobulin A Dermatoses // Clinical and basic immunodermatology / ed. Anthony A. Gaspari, Stephen K. Tyring. — Springer, London, 2008. — P. 771—787.
Eming R., Hertl M. Autoimmune bullous disorders // Clin. Chem. Lab. Med. — 2006. — Vol. 44. — №2. — P. 144—149.
Hertl M. Autoimmune diseases of the skin. — Springer-Verlag, Wien, 2005. — 469 p.
Seidenbaum M., Katz M. Pemphigus vulgaris: drug induced? // Drug Intell. Clin. Pharm. — 1987. — Vol. 21. — №12. — P. 1012.
Thivolet J. Le pemphigus paraneoplasique est-il un pemphigus? // Ann. Dermatol. Venereol. — 1993. — Vol. 120. — №3. — P. 249.
Thivolet J. Pemphigus: past, present and future // Dermatology. — 1994. — Vol. 189. — Suppl. 2. — P. 26—29.
Глава 3.
Эпидемиология аутоиммунной пузырчатки
Аутоиммунная пузырчатка встречается в 0,75—5 случаях на 1 миллион человек в год или в 0,1—0,5 случаях на 100.000 населения [Ahmed A. R. et al., 1990; Amagai M., 2002]. В Северной Америке, Европе и Израиле ежегодный уровень заболеваемости колеблется от 0,5 до 1,6 новых случаев на 100.000 населения [Tsankov N. et al., 2000]. В Иране — до 5 случаев на 100.000 населения [Asilian A. et al., 2006]. Подобные колебания в цифрах, вероятно, связаны с географическим расположением страны, национальностью, традициями и культурой народов, населяющих ту или иную страну. Например, в Македонии заболеваемость аутоиммунной пузырчаткой среди румын выше, чем среди этнических албанцев (2,4 и 0,1 случаев на 100.000 населения соответственно) [V’lckova-Laskoska M. T. et al., 2007]. В Европе наиболее часто аутоиммунную пузырчатку диагностируют у евреев ашкенази и жителей Средиземноморья [Bystryn J.-C., Rudolph J. L., 2005; Mimouni D. et al., 2008]. При этом клинические формы заболевания варьируются в различных странах. Так, вульгарная пузырчатка наиболее часто встречается в Европе и США, а листовидная пузырчатка — в Африке, Бразилии, Индии и на Аравийском полуострове, где поражено около 3% популяции [Aboobaker J. et al., 2001; Alsaleh Q. A. et al., 1999; Hafeez Z. H., 1998; Hans–Filho G. et al., 1996; Mahé A. et al., 1996; Salmanpour R. et al., 2006].
В областях, где вульгарная пузырчатка и листовидная пузырчатка являются эндемическими, соотношение случаев листовидной пузырчатки и вульгарной пузырчатки составляет 20:1 [Hilario-Vargas J. et al., 2006; Warren S. J. P. et al., 2000]. Ежегодный рост листовидной пузырчатки на 2,5% среди детей и лиц молодого возраста отмечается в Бразилии. Преобладание эритематозной пузырчатки отмечают в Финляндии [Hietanen J., Salo O. P., 1982].
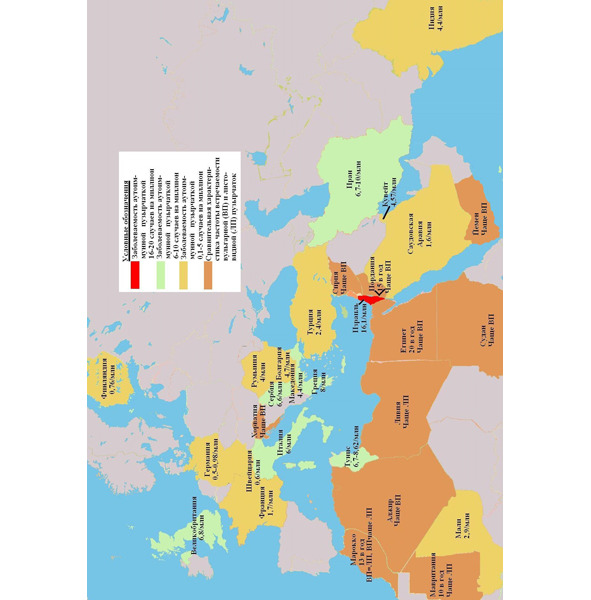
Такое географическое распределение пузырчатки по ее клиническим формам позволяет рассматривать западный мировой тип болезни с преобладанием вульгарной пузырчатки и тип развивающихся стран с распространением поверхностных форм пузырчатки (себорейная, листовидная), особенно среди лиц молодого возраста [Stanley J. R., 2003]. Обобщенная эпидемиологическая картина заболеваемости аутоиммунной пузырчаткой среди населения в некоторых странах Европы, Ближнего Востока и северной части Африки, Индии представлена на рис. 3.1.
Аутоиммунная пузырчатка, как правило, поражает человека в любом возрасте, но наиболее часто диагностируется в возрасте 40—60 лет (средний возраст — 55±18 лет), например у лиц еврейской национальности и других народов Средиземного, а также Японского морей [Bystryn J.-C., Rudolph J. L., 2005; Mimouni D. et al., 2008]. Более раннее развитие болезни (до 40 лет) отмечено в Индии (районы Пенджаб и Гайана) [Kanwar A. J. et al., 2006]. Описаны случаи возникновения аутоиммунной пузырчатки у лиц моложе 16 лет и проявления признаков болезни у новорожденного, мать которого страдает аутоиммунной пузырчаткой [Yazganoğlu K. D. et al., 2006].
Считают, что мужчины и женщины подвержены этому заболеванию в равной степени [Amagai M., 2004; Sánchez-Pérez J., García-Díez A., 2005; Stanley J. R., 2003]. Однако в ряде работ отмечается преобладание женского или мужского полов [Esmaili N. et al., 2007; Micali G. et al., 1998; Salmanpour R. et al., 2006; Tallab T. et al., 2001; Tsankov N. et al., 2000]. Например, в Испании, Мадриде и Севилье чаще аутоиммунной пузырчаткой страдают женщины, а в Малаге — мужчины [Alcaide-Martín A. J. et.al., 2010; Coronel-Pérez I. M. et al., 2009; Pérez-Bernal A. M. et al., 1992; Rivera R. et al., 2004]. В Саудовской Аравии зарегистрировано преобладание мужского пола над женским [Tallab T. et al., 2001]. В Тунисе листовидной пузырчаткой страдают чаще женщины [Kallel Sellami M. et al., 2004]. По нашим данным в Москве и Московском регионе преобладают лица женского пола (соотношение женщин/мужчин составляет 2,6:1). Кроме того, работы ряда исследователей указывают на связь между полом пациента и возрастом начала заболевания. Так, в Испании, Иране и Саудовской Аравии отмечено, что средний возраст в момент манифестации заболевания у женщин значительно выше, чем у мужчин [Esmaili N. et al., 2007; Salmanpour R. et al., 2006]. Напротив, в ряде других стран возраст мужчин преобладал над женским [Micali G. et al., 1998; Tsankov N. et al., 2000].
В Бразилии, где живут около 15000 больных, страдающих листовидной пузырчаткой, около 3,4% случаев приходится на территорию американо-индейской резервации Limao Verde [Hilario-Vargas J. et al., 2006; Warren S. J. P. et al., 2000]. Эта форма листовидной пузырчатки (бразильская, или эндемическая) ассоциируется с генами локуса HLA-DRбета1*1402, 1406, 0102, 0101 и 0404 с преобладанием двух последних аллелей и обычно поражает подростков и лиц в возрасте около 20 лет [Loiseau P. et al., 2000; Moraes J. R. et al., 1991]. Кроме того, для эндемической пузырчатки характерно поражение нескольких членов семьи, что также свидетельствует о генетической природе заболевания. Возможно воздействие факторов окружающей среды, которые остаются пока неидентифицированными. Отдельные авторы роль в возникновении листовидной бразильской пузырчатки инкриминируют особому вирусу и черной мухе семейства Simuliidae (S. pruinosum) как агенту его передачи [Aoki V. et al., 2004; Diaz L. A. et al., 1989; Lombardi C. et al., 1992].
Нередкое сочетание пузырчатки с многочисленными аутоиммунными процессами иной природы свидетельствует об аномалии иммунной регуляции. Семейная вульгарная пузырчатка является редким заболеванием. Только несколько случаев описано в английской литературе с момента первого сообщения [Ahmed A. R. et al., 1993; Feldman S., 1936; Firooz A. et al., 1994]. Поскольку она редко поражает более чем одного члена семьи и возникает у людей с различными HLA-типами, по мнению ряда авторов, аутоиммунная пузырчатка не может рассматриваться как наследственное заболевание [Bystryn J.-C., Rudolph J. L., 2005]. В то же время обнаружение на популяционном уровне сочетания аутоиммунной пузырчатки с особым HLA-гаплотипом подтверждает генетическую предрасположенность организма к этому заболеванию.
Первоначальное исследование антигенов HLA I класса показало высокую частоту выявления HLA-A10 и B13 среди пациентов вульгарной пузырчаткой [Hashimoto K. et al., 1977; Krain L. S. et al., 1973]. В Японии отмечена связь данного буллезного дерматоза с HLA-B15, включая аллели B*1507; в Турции — HLA-B35, B44 [Bordel-Gómez M. T. et al., 2006; Lombardi M. L. et al., 1999; Miyagawa S. et al., 2002; Sáenz-Cantele A. M. et al., 2007].
Изучение антигенов HLA II класса позволило выявить у пациентов с вульгарной пузырчаткой HLA-DQ и HLA-DR4. Последний является антигеном, экспрессируемым в 90% случаев у больных пузырчаткой еврейской и у 60% — японской национальности [Ahmed A. R. et al., 1987, 1991; Reohr P. B. et al., 1992]. При этом выявляемые отличия генов зависели от этнического происхождения. Так, HLA-DRбета1*0402, ассоциируемый с болезнью, встречается у лиц еврейской национальности, а DRбета1*1401/04 и DQбета1*0503 — у пациентов европейского или азиатского происхождения [Ahmed A. R. et al., 1990, 1991; Loiseau P. et al., 2000].
Предполагают, что развитие пузырчатки обусловлено присутствием цепочки 1 DQ, связанной с редким аллелем DR-бетаW6 (подтип DR4), который обнаруживается у 86% больных вульгарной пузырчаткой и только в 3% здоровой популяции без клинических проявлений заболевания [Niizeki H. et al., 1994; Reohr P. B. et al., 1992]. Другие авторы продемонстрировали, что DR14, ассоциированный с редким аллелем DQбета (DQбета1*0503), является главным предрасполагающим фактором в развитии вульгарной пузырчатки [Sinha A. A. et., 1988]. Это получило подтверждение и в дальнейших исследованиях. Так, в Пакистане среди больных вульгарной пузырчаткой обнаружена связь аутоантител с DQбета1*0503, а среди здоровых родственников этих больных — носительство гаплотипов HLA-DR4/DQ8 и DR14/DQ5, которые проявляются выработкой низких титров десмоглеин 3 специфических аутоантител, характерных для вульгарной пузырчатки [Ahmed A. R. et al., 1993; Brandsen R. et al., 1997; Delgado J. C. et al., 1997; Kricheli D. et al., 2000].
В случаях лекарственно-индуцированной пузырчатки превалируют аллели HLA II класса, такие как НLА-DR бета1*0402 и бета1*1401 (в отсутствии в связи с DQбета1*0503). В случаях паранеопластической пузырчатки — HLA-DRбета1*03 [Matzner Y. et al., 1995].
Интересны данные ряда исследователей, которые указывают на особую роль HLA-DR11, DQ7 и DQ2, носительство которых обеспечивает человеку «защиту» от развития аутоиммунной пузырчатки [Birol A. et al., 2002]. Это требует дальнейшего исследования и более углубленного изучения роли главного комплекса гистосовместимости в патогенезе аутоиммунной пузырчатки.

Иллюстративный материал
Рисунок 3.1. Заболеваемость аутоиммунной пузырчаткой в некоторых странах мира.
Библиография
Aboobaker J., Morar N., Ramdial P. K., Hammond M. G. Pemphigus in South Africa // Int. J. Dermatol. — 2001. — Vol. 40. — №2. — P. 115—119.
Ahmed A. R., Park M. S., Tiwari J. L., Terasaki P. I. Association of DR4 with pemphigus // Exp. Clin. Immunogenet. — 1987. — Vol. 4. — №1. — P. 8—16.
Ahmed A. R., Yunis E. J., Khatri K., Wagner R., Notani G., Awdeh Z., Alper C. A. Major histocompatibility complex haplotype studies in Ashkenazi Jewish patients with pemphigus vulgaris // Proc. Nat. Acad. Sci. USA. — 1990. — Vol. 87. — №19. — P. 7658—7662.
Ahmed A. R., Wagner R., Khatri K., Notani G., Awdeh Z., Alper C. A., Yunis E. J. Major histocompatibility complex haplotypes and class II genes in non-Jewish patients with pemphigus vulgaris // Proc. Nat. Acad. Sci. USA. — 1991. — Vol. 88. — №11. — P. 5056—5060.
Ahmed A. R., Mohimen A., Yunis E., Mirza N. M., Kumar V., Beutner E. H., Alper C. A. Linkage of pemphigus vulgaris antibody to the major histocompatibility complex in healthy relatives of patients // J. Exp. Med. — 1993. — Vol. 177. — №2. — P. 419—424.
Alcaide-Martín A. J., Gallardo-Pérez M. A., Castillo-Muñoz R., Mendiola Fernández M. V., Herrera-Ceballos E. Estudio epidemiologico de 20 casos de penfigo en el Hospital Clinico Universitario Virgen de la Victoria de Malaga // Actas Dermosifiliogr. — 2010. — Vol. 101. — №6. — P. 524—533.
Alsaleh Q. A., Nanda A., Al‐Baghli N. M., Dvorak R. Pemphigus in Kuwait // Int. J. Dermatol. — 1999. — Vol. 38. — №5. — P. 351—356.
Amagai M. Pemphigus // Bolognia J. L., Jorizzo J. L., Rapini R. P. Dermatology. — New York: Mosby, 2002. — P. 449—462.
Amagai M. Pénfigo // Bolognia J. L., Jorizzo J. L., Rapini R. P., Horn T. D., Mascaró J. M., Mancini A. J., ed. Dermatología. — Madrid: Elsevier España S.A., 2004. — P. 449—462.
Aoki V., Millikan R. C., Rivitti E. A., Hans-Filho G., Eaton D. P., Warren S. J., Li N., Hilario-Vargas J., Hoffmann R. G., Diaz L. A. Environmental risk factors in endemic pemphigus foliaceus (fogo selvagem) // J. Investig Dermatol. Symp. Proc. — 2004. — Vol. 9. — №1. — P. 34—40.
Asilian A., Yoosefi A., Faghini G. Pemphigus vulgaris in Iran: epidemiology and clinical profile // Skinmed. — 2006. — Vol. 5. — №2. — P. 69—71.
Birol A., Anadolu R. Y., Tutkak H., Gürgey E. HLA‐class 1 and class 2 antigens in Turkish patients with pemphigus // Int. J. Dermatol. — 2002. — Vol. 41. — №2. — P. 79—83.
Bordel-Gómez M. T., Sánchez-Estella J., Yuste-Chaves M., Santos-Durán J. C., Alonso-San Pablo M. T. [Familial pemphigus vulgaris: immunogenetic study of HLA class II antigens] // Actas Dermosifiliogr. — 2006. — Vol. 97. — №8. — P. 509—513.
Brandsen R., Frusic-Zlotkin M., Lyubimov H., Yunes F., Michel B., Tamir A., Milner Y., Brenner S. Circulating pemphigus IgG in families of patients with pemphigus: comparison of indirect immunofluorescence, direct immunofluorescence and immunoblotting // J. Am. Acad. Dermatol. — 1997. — Vol. 36. — №1. — P. 44—52.
Bystryn J.-C., Rudolph J. L. Pemphigus // Lancent. — 2005. — Vol. 366. — №9479. — P. 61—73.
Coronel-Pérez I. M., Rodriguez-Rey E. M., Pérez-Bernal A. M., Camacho F. M. Epidemiologia del penfigo en el Hospital Universitario Virgen Macarena (2005—2006) // Actas Dermosifiliogr. — 2009. — №2. — Vol. 100. — P. 121—125.
Delgado J. C., Hameed A., Yunis J. J., Bhol K., Rojas A. I., Rehman S. B., Khan A. A., Ahmad M., Alper C. A., Ahmed A. R., Yunis E. J. Pemphigus vulgaris autoantibody response is linked to HLA-DQB1*0503 in Pakistani patients // Hum. Immunol. — 1997. — Vol. 57. — №2. — P. 110—119.
Diaz L. A., Sampaio S. A. P., Rivitti E. A., Martins C. R., Cunha P. R., Lombardi C., Almeida F. A., Castro R. M., Macca M. L., Lavrado C., Filho G. H., Borges P., Chaul A., Minelli L., Empinotti J. C., Friedman H., Campbell I., Labib R. S., Anhalt G. J. Endemic pemphigus foliaceus (Fogo selvagem): II. Current and historic epidemiologic studies // J. Am. Acad. Dermatol. — 1989. — Vol. 92. — №1. — P. 4—12.
Esmaili N., Chams-Davatchi C., Valikhani M., Daneshpazhooh M., Balighi K., Hallaji Z., Barzegari M., Akhyani M., Ghodsi Z. S., Mrotazavi H., Naraghi Z. S., Toosi S. Pemphigus vulgaris in Iran: a clinical study of 140 cases // Int. J. Dermatol. — 2007. — Vol. 46. — №11. — P. 1166—1170.
Feldman S. Pemphigus in brothers // Arch. Dermatol. Syph. — 1936. — Vol. 33. — №4. — P. 730.
Firooz A., Mazhar A., Ahmed A. R. Prevalence of autoimmune diseases in the family members of patients with pemphigus vulgaris // J. Am. Acad. Dermatol. — 1994. — Vol. 31. — №3. — P. 434—437.
Hafeez Z. H. Pemphigus in Pakistan, a study of 108 cases // J. Pak. Med. Assoc. — 1998. — №1. — Vol. 48. — P. 9—10.
Hans-Filho G., dos Santos V., Katayama J. H., Aoki V., Rivitti E. A., Sampaio S. A., Friedman H., Moraes J. R., Moraes M. E., Eaton D. P., Lopez A. L., Hoffman R. G., Fairley J. A., Giudice G. J., Diaz L. A. An active focus of high prevalence of fogo selvagem on an Amerindian reservation in Brazil // J. Invest. Dermatol. — 1996. — Vol. 107. — №1. — P. 68—75.
Hashimoto K., Miki Y., Nakata S., Matsuyama M. HLA-A10 in pemphigus among Japanese // Arch. Dermatol. — 1977. — Vol. 113. — №11. — P. 1518—1519.
Hietanen J., Salo O. P. Pemphigus: an epidemiological study of patients treated in Finnish hospitals between 1969 and 1978 // Acta Dermatol. Venereol. — 1982. — Vol. 62. — №6. — P. 491—496.
Hilario-Vargas J., Dasher D. A., Li N., Aoki V., Hans-Filho G., dos Santos V., Qaqish B. F., Rivitti E. A., Diaz L. A. Prevalence of anti-desmoglein-3 antibodies in endemic regions of Fogo selvagem in Brazil // J. Invest. Dermatol. — 2006. — Vol. 126. — №9. — P. 2044—2048.
Kallel Sellami M., Ben Ayed M., Mouquet H., Drouot L., Zitouni M., Mokni M., Cerruti M., Turki H., Fezza B., Mokhtar I., Ben Osman A., Zahaf A., Kamoun M. R., Joly P., Masmoudi H., Makni S., Tron F., Gilbert D. Anti‐desmoglein 1 antibodies in Tunisian healthy subjects: arguments for the role of environmental factors in the occurrence of Tunisian pemphigus foliaceus // Clin. Exp. Immunol. — 2004. — Vol. 137. — №1. — P. 195—200.
Kanwar A. J., Ajith A. C., Narang T. Pemphigus in north India // J. Cutan. Med. Surg. — 2006. — Vol. 10. — №1. — P. 21—25.
Krain L. S., Terasaki P. I., Newcomer V. D., Mickey M. R. Increased frequency of HL-A10 in pemphigus vulgaris // Arch. Dermatol. — 1973. — Vol. 108. — №6. — P. 803—805.
Kricheli D., David M., Frusic‐Zlotkin M., Goldsmith D., Rabinov M., Sulkes J., Milner Y. The distribution of pemphigus vulgaris‐IgG subclasses and their reactivity with desmoglein 3 and 1 in pemphigus patients and their first‐degree relatives // Br. J. Dermatol. — 2000. — Vol. 143. — №2. — P. 337—342.
Loiseau P., Lecleach L., Prost C., Lepage V., Busson M., Bastuji-Garin S., Roujeau J. C., Charron D. HLA class II polymorphism contributes to specify desmoglein derived peptides in pemphigus vulgaris and pemphigus foliaceus // J. Autoimmun. — 2000. — Vol. 15. — №1. — P. 67—73.
Lombardi C., Borges P. C., Chaul A., Sampaio S. A. P., Rivitti E. A., Friedman H. et al. Environmental risk factors in endemic pemphigus foliaceus (fogo selvagem) // J. Invest. Dermatol. — 1992. — Vol. 98. — №6. — P. 847—850.
Lombardi M. L., Mercuro O., Ruocco V., Lo Schiavo A., Lombari V., Guerrera V., Pirozzi G., Manzo C. Common human leukocyte antigen alleles in pemphigus vulgaris and pemphigus foliaceus Italian patients // J. Invest. Dermatol. — 1999. — Vol. 113. — №1. — P. 107—110.
Mahé A., Flageul B., Cissé I., Kéita S., Bobin P. Pemphigus in Mali: a study of 30 cases // Br. J. Dermatol. — 1996. — Vol. 134. — №1. — P. 114—119.
Matzner Y., Erlich H. A., Brautbar C., Sanilevitch A., Landau M., Brenner S., Friedmann A. Identical HLA class II alleles predispose to drug-triggered and idiopathic pemphigus vulgaris // Acta Derm. Venereol. — 1995. — Vol. 75. — №1. — P. 12—14.
Micali G., Musumeci M. L., Nasca M. R. Epidemiologic analysis and clinical course of 84 consecutive cases of pemphigus in eastern Sicily // Int. J. Dermatol. — 1998. — Vol. 37. — №3. — P. 197—200.
Mimouni D., Bar H., Gdalevich M., Katzenelson V., David M. Pemphigus — analysis of epidemiological factors in 155 patients // J. Eur. Acad. Dermatol. Venereol. — 2008. — Vol. 22. — №10. — P. 1232—1235.
Miyagawa S., Niizeki H., Yamashina Y., Kaneshige T. Genotyping for HLA-A, B and C alleles in Japanese patients with pemphigus: prevalence of Asian alleles of the HLA-B15 family // Br. J. Dermatol. — 2002. — Vol. 146. — №1. — P. 52—58.
Moraes J. R., Moraes M. E., Fernandez-Vina M., Diaz L. A., Friedman H., Campbell I. T., Alvarez R. R., Sampaio S. A., Rivitti E. A., Stastny P. HLA antigens and risk for development of pemphigus foliaceus (fogo selvagem) in endemic areas of Brazil // Immunogenetics. — 1991. — Vol. 33. — №№5—6. — P. 388—391.
Niizeki H., Inoko H., Mizuki N., Inamoto N., Watababe K. Hashimoto T., Nishikawa T. HLA-DQA1, -DQB1 and -DRB1 genotyping in Japanese pemphigus vulgaris patients by the PCR-RFLP method // Tissue antigens. — 1994. — Vol. 44. — №4. — P. 248—251.
Pérez-Bernal A. M., Moreno J. C., Camacho F. Ten years’ experience of the treatment of 34 cases of pemphigus // J. Dermatolog Treat. — 1992. — №3. — P. 73—75.
Reohr P. B., Mangklabruks A., Janiga A. M., DeGroot L. J., Benjasuratwong Y., Soltani K. Pemphigus vulgaris in siblings: HLA-DR and HLA-DQw3 and susceptibility to pemphigus // J. Am. Acad. Dermatol. — 1992. — Vol. 27. — №2. — P. 189—193.
Rivera R., Postigo C., de la Mano D., Vanaclocha F., Iglesias L. Penfigo: estudio retrospectivo de 52 casos // Actas Dermosifiliogr. — 2004. — Vol. 95. — P. 213—218.
Sáenz‐Cantele A. M., Fernández‐Mestre M., Montagnani S., Calebotta A., Balbas O., Layrisse Z. HLA‐DRB1* 0402 haplotypes without DQB1* 0302 in Venezuelan patients with pemphigus vulgaris // Tissue antigens. — 2007. — Vol. 69. — №4. — P. 318—325.
Salmanpour R., Shahkar H., Namazi M. R., Rahman-Shenas M. R. Epidemiology of pemphigus in south-western Iran: a 10-year restrospective study (1991–2000) // Int. J. Dermatol. — 2006. — Vol. 45. — №2. — P. 103—105.
Sánchez-Pérez J., García-Díez A. Pénfigo // Actas Dermosifiliogr. — 2005. — Vol. 96. — №6. — P. 329—356.
Sinha A. A., Brautbar C., Szafer F., Friedmann A., Tzfoni E., Todd J. A., Steinman L., McDevitt H. O. A newly characterized HLA DQ beta allele associated with pemphigus vulgaris // Science. — 1988. — Vol. 239. — №4843. — P. 1026—1029.
Stanley J. R. Pemphigus // Fitzpatrick’s Dermatology in General Medicine. 6th edition. — USA: Ed. Mc Graw Hill, 2003. — P. 558—574.
Tallab T., Joharji H., Bahamdan K., Karkashan E., Mourad M., Ibrahim K. The incidence of pemphigus in the southern region of Saudi Arabia // Int. J. Dermatol. — 2001. — Vol. 40. — №9. — P. 570—572.
Tsankov N., Vassileva S., Kamarashev J., Kazandjieva J., Kuzeva V. Epidemiology of pemphigus in Sofia, Bulgaria. A 16-year retrospective study (1980–1995) // Int. J. Dermatol. — 2000. — Vol. 39. — №2. — P. 104—108.
V’lckova‐Laskoska M. T., Laskoski D. S., Kamberova S., Caca‐Biljanovska N., Volckova N. Epidemiology of pemphigus in Macedonia: A 15‐year retrospective study (1990–2004) // Int. J. Dermatol. — 2007. — Vol. 46. — №3. — P. 253—258.
Warren S. J. P., Lin M. S., Giudice G. J., Hoffmann R. G., Hans-Filho G., Aoki V., Rivitti E. A., Santos V., Diaz L. A. The prevalence of antibodies against desmoglein 1 in endemic pemphigus foliaceus in Brazil // N. Engl. J. Med. — 2000. — Vol. 343. — №1. — P. 23—30.
Yazganoğlu K. D., Baykal C., Küçükoğlu R. Childhood pemphigus vulgaris: five cases in 16 years // J. Dermatol. — 2006. — Vol. 33. — №12. — P. 846—849.
Глава 4.
Иммуннопатология аутоиммунной пузырчатки
Накопленные фундаментальные знания об этом угрожающем жизни заболевании позволяют не сомневаться в истинной картине аутоиммунного происхождения пузырчатки, которую можно представить как парадигму специфического аутоиммунного заболевания органов [Stanley J. R., 1989; Thivolet J., Nicolas J. F., 1995]. Об этом свидетельствует присутствие всех признаков (клинических, цитологических, гистологических, иммунологических и иммуногистохимических), характерных для аутоиммунных заболеваний [Махнева Н. В., Белецкая Л. В., 2012; Vaillant L., 1991]:
• существование специфических аутоантител;
• появление идентичных кожных поражений у новорожденных от беременных, страдающих пузырчаткой;
• сочетание с другими аутоиммунными и иммунопатологическими процессами (например, сахарный диабет II типа, аутоиммунный тиреоидит, ревматоидный полиартрит, анемия, бронхиальная астма, аутоиммунный миокардит, миастения гравис и др.);
• присутствие особого активного генетического участка (выявление определенных гаплотипов главного комплекса гистосовместимости II класса).
Аутоантитела при аутоиммунной пузырчатке
Основным механизмом развития аутоиммунной пузырчатки является потеря связи (адгезии) между кератиноцитами (акантолиз) с последующим образованием внутриэпидермальных пузырей [Глухенький Б. Т., Грандо С. А., 1990; Ежов Н. Я., 1974; Матушевская Е. В., 1997; Потекаев Н. С., 2004; Цветкова Г. М. с соавт., 2003; Beutner E. H. et al., 1973; Iwatsuki K. et al., 1989]. Разрыв связей между клетками эпидермиса возникает в результате воздействия аутоантител на антигены межклеточной субстанции (белков десмосомального аппарата, молекул адгезии) многослойного плоского эпителия (кожа, слизистая оболочка полости рта, пищевода и других органов) (рис. 4.1). Они обладают высокой тканевой специфичностью и относятся к классу иммуноглобулина (Ig) G (рис. 4.2, a). Антитела не реагируют ни с одним из антигенов тканей других органов, кроме антигенов межклеточной субстанции эпителия телец Гассаля тимуса человека и животных (рис. 4.2, b) [Белецкая Л. В., Гнездицкая Э. В., 1974].
Все клинические формы аутоиммунной пузырчатки характеризуются присутствием в крови аутоантител и фиксацией в межклеточных пространствах эпидермиса иммуноглобулина класса G (рис. 4.2, с). Вместе с тем при разных формах пузырчатки уровень и интенсивность фиксации аутоантител в эпителии кожи иммуноглобулина различны. Наиболее интенсивная фиксация антител в эпидермисе наблюдается при вульгарной пузырчатке и выявляется у 70—90% больных [Bhol K. et al., 1994; Bystryn J.-C., Rudolph J. L., 2005; David M. et al., 1989; Jones C. C. et al., 1988]. Циркулирующие межклеточные антитела отмечаются у 80% пациентов с активным патологическим процессом. При этом их титры, определяемые непрямым методом иммунофлюоресценции, обычно коррелируют с активностью болезни [Fitzpatrick R. E., Newcomer V. D., 1980; Friedman H. et al., 1989; Sams W. M. Jr., Jordon R. E., 1971; Squiquera H. L. et al., 1988]. В то же время имеются сообщения некоторых ученых, которые не всегда выявляли корреляцию титра антител к антигенам межклеточной субстанции с активностью или тяжестью течения аутоиммунной пузырчатки [Махнева Н. В., Белецкая Л. В., 2012; de Messias I. T. et al., 1988]. Отсутствие корреляции титра антител к антигенам межклеточной субстанции с активностью или тяжестью течения заболевания связано со способностью кожи сорбировать иммунные комплексы с целью их элиминации, поэтому при обширных поражениях кожи, порой с захватом целых анатомических областей и слизистой оболочки, циркулирующие аутоантитела не всегда удается выявить. И наоборот, в случае локального патологического процесса титр аутоантител может достигать высоких цифр (до 1:10240). На основании полученных результатов исследования предложена теория, что подобные изменения объясняются прочностью гистогематического барьера между кровотоком и тканями у некоторых больных [Махнева Н. В., Белецкая Л. В., 2012].
Отмечено также, что присутствие циркулирующих антител у беременных женщин, страдающих аутоиммунной пузырчаткой, является причиной появления подобных поражений у новорожденных, которые исчезают у последних через несколько недель [Kalyan B., Raghubir B., 1994; Merlob P. et al., 1986; Okano M. et al., 1990; Rocha-Alvarez R. et al., 1992; Storer J. S. et al., 1982]. Передача болезни плацентарным (пассивным) путем от матери к ребенку является весомым аргументом в пользу эксклюзивной роли антител класса IgG в появлении поражений, характерных для аутоиммунной пузырчатки [Amer Y. B., Al Ajroush W., 2007; Fenniche S. et al., 2006; Tope W. D. et al., 1993; Wasserstrum N., Laros R. K., 1983].
Впервые присутствие аутоантител в сыворотке крови больных пузырчаткой было показано Beutner E. N. и Jordon R. E. (1964), а в дальнейшем подтверждено экспериментально Michel B. и Schiltz J. R. (1974, 1976), Hashimoto K. и соавт. (1982, 1983). Индукция акантолиза в культуре клеток кератиноцитов с использованием сывороток больных, страдающих пузырчаткой, выявила способность IgG-антител вульгарной пузырчатки самостоятельно, без присутствия комплемента, вызывать потерю межклеточной адгезии. Результаты исследований, полученные in vitro этими авторами, были подтверждены экспериментально in vivo на новорожденных мышах [Anhalt G. J. et al., 1982; Cirillo N. et al., 2007; Juhasz I. et al., 1993].
Акантолиз у новорожденных мышей был вызван введением сыворотки крови, содержащей IgG больных в активной стадии вульгарной пузырчатки, тогда как сыворотки крови, содержащие IgG больных вульгарной пузырчаткой в стадии ремиссии и здоровых доноров с HLA-ассоциацией с вульгарной пузырчаткой, не провоцировали развитие акантолиза [Amagai M. et al.,1991]. Это свидетельствует о том, что клиническое проявление заболевания является прямым следствием воздействия аутоантител [Anhalt G. J. et al., 1982, 1986]. Дополнительным подтверждением роли IgG явились исследования in vitro, в которых при культивировании человеческой кожи с добавлением IgG из сыворотки крови больных вульгарной пузырчаткой был продемонстрирован акантолиз [Woo T. Y. et al., 1983].
Таким образом, роль IgG-аутоантител в патогенезе аутоиммунной пузырчатки не оспаривается. Однако не менее важным и интересным моментом в изучении механизмов развития данной патологии является определение значения субклассов IgG, которые отличаются друг от друга аминокислотным составом и биологическими свойствами.
Субклассовая характеристика иммуноглобулина класса G
при аутоиммунной пузырчатке
Известно, что IgG составляет около 75% антител сыворотки крови и включает в себя 4 субкласса (IgG1, IgG2, IgG3, IgG4) [Stanworth D. R., Turner M. W., 1978]. Наиболее часто (67% от общего уровня IgG) в сыворотке крови человека выявляется субкласс IgG1. На долю IgG2, IgG3 и IgG4 приходится 22, 7 и 4% соответственно.
Известно, что субклассы IgG ассоциируются с различными функциональными и антигенными свойствами, поэтому их роль отличается в развитии некоторых патологических процессов. Так, IgG1, IgG2, IgG3 способны связывать комплемент, в отличие от IgG4, который его не связывает. При этом все субклассы IgG проходят через плацентарный барьер и участвуют во вторичном иммунном ответе, нейтрализуя действия токсинов и вирусов. Антитела субклассов IgG1 и IgG3 вырабатываются в ответ на белковые антигены, а IgG2 и IgG4-антитела — на антигены гликопротеиновой природы [Schroeder H. W., Cavacini L., 2010; Schur P. H., 1987].
При исследовании сыворотки крови больных пузырчаткой у большинства пациентов были обнаружены все 4 субкласса IgG-антител. Исследователи выдвинули предположение, что IgG-антитела пузырчатки содержат все 4 вида субклассов [Kanwar A. J. et al., 1997]. Однако дальнейшее изучение проблемы выявило различное распределение субклассов IgG в образцах сыворотки больных пузырчаткой [Bhol K. et al., 1995; David M. et al., 1989]. Так, на развитие эндемической листовидной пузырчатки наибольшее влияние оказывают IgG4-аутоантитела [Rock B. et al., 1989]. При других клинических формах пузырчатки основным субклассом является IgG1; а IgG4 — самый редкий субкласс, он встречается реже, чем IgG2 и IgG3 [Bhol K. et al., 1994]. Напротив, в исследованиях того же времени непрямым методом иммунофлюоресценции во всех случаях продемонстрировали преобладание специфичных IgG4-аутоантител, тогда как IgG1-антитела обнаруживались лишь в части сывороток при более низком разведении, IgG2 не определялся, а IgG3-антитела выявлялись крайне редко [Jones C. C. et al., 1988]. Подобной диссоциацией иммуноглобулинов пытались объяснить различные клинические проявления у больных аутоиммунной пузырчаткой.
Во многих исследованиях было показано, что у пациентов в активной стадии вульгарной пузырчатки выявляются высокие титры IgG1 и IgG4-аутоантител, что свидетельствует об их патогенетической роли при данном заболевании [Bhol K. et al., 1994; Rock B. et al., 1989; Warren S. J. P. et al., 2003]. Другие авторы свидетельствуют о том, что гуморальный ответ в активной стадии вульгарной пузырчатки обусловлен чаще субклассом IgG4, а в стадии ее ремиссии — IgG1 [David M. et al., 1989].
При листовидной пузырчатке распределение субклассов IgG сходно с таковым при вульгарной пузырчатке: в стадии активного процесса преобладают IgG4-аутоантитела, а в доклинической стадии и стадии ремиссии болезни — IgG1 [Hacker-Foegen M. K. et al., 2002; Li N. et al., 2003; Rock B. et al., 1989; Warren S. J. P. et al., 2003]. Пациенты с длительной клинической ремиссией, их здоровые родственники и здоровая группа контроля имеют низкие титры IgG1-аутоантител к эпидермальным белкам [Bhol K. et al., 1994]. Выявление низких титров IgG1 в контрольной группе у здоровых лиц можно объяснить тем, что они являются наиболее распространенным среди всех субклассов IgG [Schroeder H. W., Cavacini L., 2010]. Ряд исследователей [David M. et al., 1989] отмечают интересный факт — если IgG1 определялся только на ранних стадиях клинических проявлений аутоиммунной пузырчатки, то IgG4 обнаруживался на протяжении всего периода болезни. Эти результаты позволяют предположить, что переход от доклинической стадии в клиническую стадию заболевания, а также переход заболевания от стадии ремиссии к активному процессу тесно связаны с переходом субклассов от IgG1 к IgG4. Кроме того, полученные результаты показывают, что IgG1-антитела сами по себе не в состоянии вызвать болезнь. Так, Lin M. S. и соавт. (2001) установили, что IgG1-антитела здорового человека, имеющего только IgG1-ответ, не способны вызвать клинические проявления болезни в экспериментальной модели на животных (мыши) при их введении в дозе 15 мг/кг. Вместе с тем IgG4-антитела больных пузырчаткой способны спровоцировать развитие болезни при использовании малых доз IgG4-антител (1,5 мг/кг), т. е. при концентрации в 10 раз меньшей, чем при введении IgG1-антител.
Таким образом, работы многих исследователей установили, что IgG4 является доминирующим субклассом в патогенезе пузырчатки. В период активности болезни отмечено высокое (до 85% случаев) содержание в сыворотках больных пузырчаткой как IgG1, так и IgG4, а в период ремиссии одни авторы подчеркивают значительное (до 79% случаев) содержание IgG4, другие констатировали наличие только IgG1 [Bhol K. et al., 1994; David M. et al., 1989; Jones C. C. et al., 1988; Sampaio S. A. et al., 1994; Trémeau-Martinage C. et al., 1995]. Возможно, подобное явление объясняется генетическими особенностями организма больного. Исследования позволили также предположить, что снижение концентрации IgG3 и C3 компонента комплемента могут предшествовать началу ремиссии заболевания [David M. et al., 1989]. Следует отметить, что большинство сывороток больных пузырчаткой, содержащих IgG1-IgG3-антитела в различных образцах, не показывали усиления активности комплемента, в то время как сыворотки, содержащие только IgG4, обнаруживали фиксацию компонентов комплемента.
В 70-е гг. прошлого столетия методом хроматографии было показано, что сыворотки больных пузырчаткой, в состав которых входили все четыре субкласса IgG, никогда не фиксировали комплемент [Sams W. M. Jr., Schur P. H., 1973]. Это явление характерно для формирования неполных иммунных комплексов. Многочисленные исследования демонстрируют, что IgG-фракции больных пузырчаткой самостоятельно, без участия комплемента, индуцируют акантолиз в культуре ткани [Farb R. M. et al., 1978; Schiltz J., Michel B., 1976; Singer K. H. et al., 1980]. Высокая концентрация IgG в тканях способствует освобождению протеаз, активации плазминогена и вовлечению их в патологический процесс [Hashimoto K. et al., 1983; Morioka S. et al., 1984]. Экспериментально продемонстрировано, что очищенный ингибитор активатора плазминогена 2 плаценты человека может предотвращать в культуре клеток акантолитические изменения, индуцируемые IgG-антителами пузырчатки [Hashimoto K. et al., 1989].
По нашим данным при изучении субклассовой характеристики циркулирующих IgG-аутоантител в сыворотке крови больных было выявлено, что у всех (100%) больных независимо от клинической формы и стадии развития пузырчатки присутствовали IgG2-аутоантитела и в 86,2% случаях — IgG4-аутоантитела [Махнева Н. В. с соавт., 2013]. Преобладание IgG2/IgG4-аутоантител свидетельствует о хронической антигенной стимуляции, преимущественно гликопротеиновой природы. IgG1 и IgG3-аутоантитела выявлены в 60,1 и 41,4% случаев соответственно (рис. 4.3).
Следует отметить, что IgG4-аутоантитела являются доминирующим субклассом на всем протяжении развития заболевания с наибольшей активностью в стадии обострения (100%). IgG1-аутоантитела проявляли наибольшую (75%) активность при впервые выявленной патологии. Вместе с тем оба указанных субкласса присутствуют и играют ключевую роль на протяжении всего периода развития болезни [Махнева Н. В. с соавт., 2013]. Об этом свидетельствуют циркулирующие аутоантитела в сыворотке больных аутоиммунной пузырчаткой в стадии ее клинической ремиссии с доминирующими (71,4%) IgG4-аутоантителами. Циркулирующие IgG1 и IgG3-антитела выявлены в данный период болезни с одинаковой частотой (по 28,6%). Таким образом, выявление выраженной иммунофлюоресцентной реакции с IgG4 и/или IgG1-аутоантителами еще раз подтверждает основную патогенетическую роль данных аутоантител в развитии и течении аутоиммунной пузырчатки.
Cистема комплемента
в патогенезе
аутоиммунной пузырчатки
Исследователями уделено большое внимание системе комплемента и роли его в развитии акантолиза. Показано, что начальные компоненты комплемента присутствуют как в коже с клиническими проявлениями пузырчатки, так и видимо здоровой, без гистологических признаков заболевания [Jordon R. E. et al., 1974; Kawana S. et al., 1989, Kawana S., Nishiyama S., 1990]. Выделенные и очищенные IgG-аутоантитела пузырчатки фиксируют ранние компоненты комплемента (C1q, C3, C4) на поверхности культуры клеток кератиноцитов [Kawana S. et al., 1984, 1988]. При добавлении комплемента к IgG отмечается усиление акантолиза и изменение целостности мембраны кератиноцитов [Doubleday C. W. et al., 1988; Kawana S. et al., 1986]. В последующем продемонстрировано, что эти изменения возможны и без вовлечения системы плазминоген-плазмин [Xia P. et al., 1988]. По-видимому, существует несколько механизмов нарушения контактов между клетками с вовлечением протеаз. Выявлено, что IgG пузырчатки фиксирует и более поздно действующие компоненты комплемента (C3-C9) на поверхности кератиноцитов, наблюдается связь C5b-C9 с неоантигенами (измененными антигенами) и последующим вовлечением мембрано-атакующего комплекса в процесс акантолиза [Kawana S. et al., 1989; Kawana S., Nishiyama S., 1990; Podack E. R. et al., 1978].
Предполагают, что комплемент (ранние его формы) может предварительно закладываться в клеточных мембранах кератиноцитов, приводя к активации поздних компонентов комплемента под воздействием аутоантител пузырчатки и локальному формированию мембрано-атакующего комплекса. Этот комплекс нарушает проницаемость цитоплазматической мембраны клеток, оказывая цитотоксическое действие [Biesecker G. et al., 1979; Müller-Eberhard H. J., 1985]. Прямым методом иммунофлюоресценции обнаружено присутствие поздних компонентов комплемента (C5, C7, C9) и комплекса неоантигенов с C5b-C9 в межклеточной субстанции пораженной кожи.
В противоположность этому, мембрано-атакующий комплекс не выявлен в клинически неповрежденной коже при пузырчатке. Фиксация иммунных комплексов, содержащих IgG и ранние компоненты комплемента в межклеточной связывающей субстанции эпидермиса, свидетельствует о развитии иммунопатологического процесса и соответствует статусу «пораженной» на вид, клинически «здоровой» кожи [Kawana S. et al., 1989].
Вместе с тем роль комплемента при пузырчатке до настоящего времени является спорной, т. к. результаты некоторых наблюдений и экспериментов in vitro свидетельствуют о необязательном участии комплемента в механизме образования пузырей [Hashimoto T. et al., 1982; Ogawa M. M. et al., 1989; Schiltz J., Michel B., 1976; Singer K. H. et al., 1980]. Не исключено, что для активации протеиназы системы плазминогена достаточно фиксации в тканях только аутоантител. В то же время другие авторы [Doubleday C. W. et al., 1988; Kawana S. et al., 1985, 1986] указывают на активное вовлечение комплемента в патогенез аутоиммунной пузырчатки, возможно, не всегда выявляемого используемыми методами.
По нашим данным циркулирующий С3 компонент комплемента присутствует одновременно с циркулирующими IgG-аутоантителами независимо от клинической формы и стадии развития болезни в низких титрах — 1:5 (рис. 4.4). Мишенью является межклеточная связывающая субстанция зернистого слоя, что совпадает с локализацией циркулирующих IgG2-аутоантител [Makhneva N. V. et al., 2013]. Это свидетельствует о связи комплемента с неполным иммунным комплексом (антиген — антитело) и их участии в качестве дополнительного фактора, в частности при переходе одной клинической формы пузырчатки в другую. Кроме того, преобладание IgG2/IgG4-антител свидетельствует о хронической антигенной стимуляции с участием системы комплемента активируемым классическим путем.
При исследовании биоптатов клинически интактных участков кожи больных аутоиммунной пузырчаткой фиксация С3 компонента комплемента выявлена в 50,6% случаев независимо от клинической формы и стадии развития болезни [Махнева Н. В., Белецкая Л. В., 2012]. Антигеном-мишенью в большинстве случаев являлись компоненты межклеточной связывающей субстанции базального слоя эпидермиса с одновременным вовлечением в процесс межклеточной связывающей субстанции шиповатого слоя и зоны базальной мембраны эпидермиса (рис. 4.5, a, b). У ряда больных наблюдалась изолированная фиксация С3 компонента комплемента только в зоне базальной мембраны эпидермиса (рис. 4.5, c). Обнаружение С3 компонента комплемента за пределами локализации антигенов-мишеней аутоиммунной пузырчатки может свидетельствовать не только об участии системы комплемента в специфической защите организма в месте локализации антигена-мишени, но и о его распространении на целый ряд структур клинически интактных участков кожи.
Таким образом, принимая во внимание возможность участия различных молекулярно-биологических механизмов в патогенезе аутоиммунной пузырчатки, проблема роли системы комплемента при этом заболевании нуждается в развитии и дальнейшем изучении [Brooks W. S. et al., 1989; Vaillant L., 1991].
Антигены-мишени при аутоиммунной пузырчатке
Важным достижением в дерматологии явилось изучение на молекулярно-биологическом уровне морфологического строения и биохимического состава кожи, что позволило выявить и идентифицировать разные антигены-мишени межклеточной субстанции (десмосомы и другие структуры) эпидермиса для антител пузырчатки и определить их принадлежность к семейству кадгеринов (рис. 4.6, 4.7) [Махнева Н. В., Белецкая Л. В., 2009; Anhalt G. J., 1999; Burge S. M. et al., 1993; Thivolet J., Nicolas J. F., 1995]. Известно, что кадгерины являются самыми распространенными молекулами клеточных элементов тканей млекопитающих [Пальцев М. А., Иванов А. А., 1995; Jones J. C. et al., 1986]. Однако в антигенном отношении кадгерины разных тканей отличаются друг от друга.
Первоначально было показано, что сыворотка больных вульгарной пузырчаткой преципитирует протеин эпидермиса молекулярным весом 210 кД, состоящий из двух компонентов с молекулярным весом 130 и 85 кД. Последние соединены между собой дисульфидными мостиками [Stanley J. R. et al., 1984]. Полученные результаты были подтверждены и другими исследователями [Akiyama M. et al., 1991; Amagai M. et al., 1992; Cowin P. et al., 1986]. Показано, что молекула весом 85 кД соответствует молекуле адгезии — плакоглобину (интрацитоплазматическая десмосомальная пластинка), которая не является характерной только для десмосом [Caldelari R. et al., 2001]. Сходные исследования, проводимые с сывороткой больных листовидной пузырчаткой, определили, что сыворотка этих больных преципитирует белок с молекулярным весом 260 кД, состоящий из двух протеинов молекулярным весом 85 и 160 кД, плакоглобина и десмоглеина соответственно. Последний является иммуноспецифическим трансмембранным гликопротеином десмосомы [Calvanico N. J., Swartz S.J., 1994; Dmochowski M. et al., 1994; Olague-Alcala M. et al., 1994]. В дальнейшем методом иммунопреципитации удалось показать, какая часть различных молекулярных компонентов носит антигенный участок-мишень в межклеточной субстанции [Korman N. J. et al., 1989]. Так, в иммунном комплексе вульгарной пузырчатки антигенный участок представлен протеином молекулярным весом 130 кД, позднее названным десмоглеином 3; а при листовидной пузырчатке антигенный участок — протеином молекулярным весом 160 кД, названный десмоглеином 1 [Allen E. M. et al., 1993; Hashimoto T. et al., 1990; Iwatsuki K. et al., 1994; Kárpáti S. et al., 1994].
Таким образом, на основании многочисленных исследований показано, что антигены-мишени в двух формах пузырчатки (вульгарная и листовидная) различны. Если при вульгарной пузырчатке межклеточные антитела преимущественно направлены против десмоглеина 3 и реже против десмоглеина 1, то при листовидной пузырчатке — исключительно против десмоглеина 1 [Arnemann J. et al., 1992; Bystryn J.-C., Rudolph J. L., 2005; Emery D. J. et al., 1995]. Экспериментально на модели животных было продемонстрировано, что анти-десмоглеин 1 IgG-аутоантитела листовидной пузырчатки также выявляются в сыворотке больных вульгарной пузырчаткой, а анти-десмоглеин 3 IgG-аутоантитела вульгарной пузырчатки — в сыворотке больных паранеопластической пузырчаткой [Amagai M., 1994; Amagai M. et al., 1994; Amagai M., 1995; Amagai M. et al., 1995; Amagai M. et al., 1998].
Однако антигеном-мишенью для патогенетических антител может быть не только целая молекула, но и различные ее эпитопы (антигенная детерминанта) (рис. 4. 8) [Свирщевская Е. В. с соавт., 2009; Amagai M. et al., 1992; Bhol K. et al., 1995; Heupel W. et al., 2008]. Так, экспериментально на мышиной модели продемонстрировано, что аффинно очищенный IgG пузырчатки на рекомбинантном протеине, представленный эктодоменами (EC) 1—2 десмоглеина 3, вызывает супрабазальный акантолиз, характерный для вульгарной пузырчатки. В противоположность, IgG аффино очищенный на рекомбинантном протеине, представленный EC3—5 десмоглеина 3, не индуцирует акантолиз [Amagai M. et al., 1992]. IgG1 и IgG4 больных вульгарной пузырчаткой в активной стадии болезни распознают эпитопы в эктодоменах 1 и 2. In vitro показано, что IgG4, направленный непосредственно против эктодомена 2 (EC2) и в меньшей степени против эктодомена 1 (EC1), вызывает акантолиз [Bhol K. et al., 1995]. На основании данных исследований выдвинуто предположение, что IgG4 против EC2 десмоглеина 3 являются основными аутоантителами, тогда как IgG4 против EC1 могут действовать как вспомогательный фактор или усилитель патологического процесса [Hertl M., 2005]. Продемонстрировано, что сыворотка больных вульгарной пузырчаткой распознает внутриклеточные эпитопы десмоглеина 3 [OhataY. et al., 2001]. Значение этой находки еще пока неясно.
Многочисленные исследования показали, что антигены-мишени аутоиммунной пузырчатки являются более гетерогенными, чем определенными (табл. 4.1) [Cozzani E. et al., 2006; Hashimoto T. et al., 1995; Kurzen H., Brenner S., 2006]. Проводимые работы с сыворотками больных листовидной пузырчаткой позволили предположить существование как водорастворимых, так и нерастворимых антигенов листовидной пузырчатки [Calvanico N. J. et al., 1991; Labib R. S. et al., 1989]. Это подтверждается исследованием и других авторов [Calvanico N. J., Swartz S. J., 1994; Martins C. R. et al., 1990], которые выявили антитела к растворимому иммуногенному гликопротеину молекулярным весом 45 кД во всех исследуемых случаях листовидной пузырчатки и в 46% сывороток больных вульгарной пузырчаткой.
Таблица 4.1. Антигены-мишени при аутоиммунной пузырчатке

Hashimoto T. и соавт. (1995) сообщили, что некоторые пациенты с вульгарной пузырчаткой имеют циркулирующие IgG-аутоантитела, реагирующие с десмоколлинами 1 и 2 в дополнение к IgG-аутоантителам против десмоглеинов 3 и 1. Подобную картину наблюдали и в случаях вегетирующей и IgA-зависимой пузырчатки [Becker B. A., Gaspari A. A., 1993; Hashimoto K. et al., 1994; Hashimoto T. et al., 1994, 1995; Parodi A. et al., 1988].
Иммуноэлектронное исследование продемонстрировало, что аутоантитела вульгарной пузырчатки связываются не только с экстрацеллюлярной или внутриклеточной частями десмосом, но также с большей частью десмосомальных структур, расположенных на поверхности кератиноцитов [Bédan C. et al., 1996; Collins J. E. et al., 1991; Horiguchi Y. et al., 1994]. Аутоантигенами пузырчатки могут быть и плакоглобин [Caldelari R. et al., 2001; Korman N. J. et al., 1989], узнаваемый циркулирующими аутоантителами различных субклассов IgG при некоторых аутоиммунных заболеваниях, и коллаген XVII типа, и энвоплакин и/или периплакин, а также рецепторы молекул [Joly P. et al., 1997; Kazerounian S. et al., 2000; Kim S. C. et al., 1997; Nguyen V. T. et al., 1998, 2000]. Исследования Nguyen V. T. и соавт. (2000) продемонстрировали, что IgG пузырчатки направлен к иным антигенам-мишеням, отличным от десмоглеина 1 и десмоглеина 3. Идентифицированы два потенциально новых аутоантигена, которые принадлежат к группе холинергических рецепторов. Пемфаксин — гомологичный аннексину, связывающий ацетилхолин [Nguyen V. T. et al., 1998, 2000]. Второй ацетилхолиновый рецептор-антиген, характерный для сыворотки IgG вульгарной пузырчатки, — альфа-9-ацетилхолиновый рецептор, присутствующий на поверхности кератиноцитов [Nguyen V. T. et al., 2000]. Роль этих аутоантител против ацетилхолиновых рецепторов кератиноцитов в патогенезе аутоиммунной пузырчатки предстоит еще научно обосновать.
Кроме того, был идентифицирован новый десмосомальный кадгерин, десмоглеин 4, который на 41% идентичен десмоглеину 1 и на 50% десмоглеину 3 [Whittock N. V., Bower C., 2003]. Показано, что сыворотка больных вульгарной пузырчаткой может также реагировать с десмоглеином 4 [Kljuic A. et al., 2003]. Несмотря на то что патогенетическое значение антител против десмоглеина 4 окончательно не выяснено, они встречаются в ассоциации с антителами против десмоглеина 1 при листовидной пузырчатке и вульгарной пузырчатке с поражением кожи и слизистых оболочек [Nagasaka T. et al., 2004].
Таким образом, ряд исследований продемонстрировали, что аутоантиген аутоиммунной пузырчатки представлен не только протеинами десмосом, но также белком, расположенным по всей поверхности кератиноцитов.
Вопросы
о субклассовой патогенности IgG-аутоантител
и эпитопной характеристике десмоглеинов
Исследования патогенности аутоантител к эпитопам десмоглеина 1 (аутоантиген листовидной пузырчатки) показали, что внутримолекулярное распространение эпитопа может быть связано с переключением субклассов IgG (см. рис. 4.8). Так, в доклинической фазе и в стадии ремиссии болезни синтезируются IgG1-аутоантитела, направленные против эктодомена 5 (EC5) карбоксильной части десмоглеина 1 [Li N. et al., 2003]. Это состояние меняется, когда болезнь переходит в активную стадию и происходит IgG4-ориентированный ответ, направленный на другие части молекулы (EC1—2), которые располагаются на амино-концах десмоглеина 1 [Lin M. S. et al., 2001]. Ранее было обнаружено, что IgG4-аутоантитела против десмоглеина 1 распознают только согласованные (конформационные) эпитопы (отдаленные участки белковой молекулы антигена, сближающиеся при образовании третичной структуры), тогда как IgG1-аутоантитела распознают как согласованные, так и линейные эпитопы (участки белковой молекулы, состоящие из последовательности аминокислот, с которыми может соединяться антитело), но не проявляют патогенность при пассивной их передаче на модели животных [Hacker-Foegen M. K. et al., 2003]. Факторы, которые могут привести к переключению IgG, играют решающую роль в развитии и дальнейшем течении пузырчатки [Aoki V. et al., 2004; Lombardi C. et al., 1992].
Ряд исследователей при анализе субклассов IgG у пациентов в эндемических районах Бразилии обнаружили, что у части пациентов выявлялись IgG4-антитела к десмоглеину 1 за несколько лет до начала клинических проявлений пузырчатки [Qaqish B.F. et al., 2009]. В некоторых работах было показано, что переход из доклинической стадии заболевания в клиническую связан с повышением уровня титров IgG4-аутоантител к десмоглеину 1 [Qaqish B.F. et al., 2009; Warren S. J. P. et al., 2003]. При обследовании сывороток здоровых людей и пациентов, живущих в эндемичных районах Бразилии, с помощью метода ELISA (enzyme-linked immunosorbent assay — иммуноферментный анализ, ИФА) было отмечено, что практически все клинически здоровые лица имеют IgG-антитела к десмоглеину 1. В течение нескольких лет наблюдения у некоторых из них произошел переход эндемической листовидной пузырчатки из доклинической стадии в клиническую. При этом в сыворотке этих пациентов титр IgG4-антител к десмоглеину 1 в самом начале кожного проявления болезни стал выше. Важно отметить, что аутоантитела в доклинической стадии были связаны с ЕС5-цепью десмоглеина 1, тогда как в клинической стадии патогенные аутоантитела распознавали эпитопы, локализующиеся только на ЕС2-цепи молекулы [Bhol K. et al., 1995; Qaqish B.F. et al., 2009].
Несмотря на многочисленные исследования, доказывающие основное влияние IgG4-аутоантител при пузырчатке, в сыворотке ряда пациентов обнаруживаются только IgG1-аутоантитела, что может свидетельствовать об индивидуальной избирательности организма больных. Так, например, при изучении эндемической листовидной пузырчатки методом ELISA было обнаружено, что у 4 из 52 пациентов выявляются только IgG1-аутоантитела к десмоглеину 1 [Hacker-Foegen M. K. et al., 2003]. Для проведения анализа тканевой специфичности аутоантител этих пациентов был применен непрямой метод иммунофлюоресценции с использованием срезов эпителиальной ткани пищевода обезьяны, кожи взрослого человека и новорожденной мыши. В процессе исследования были обнаружены только общие IgG и IgG1-аутоантитела, а IgG4 или другие изотипы аутоантител у этих пациентов отсутствовали. При этом клинические проявления аутоиммунной пузырчатки в обеих группах больных, независимо от выявления IgG4-аутоантител, были одинаковы. Для оценки патогенной активности IgG1-аутоантител in vivo применяли модель пассивной передачи заболевания на мышах [Arteaga L. A. et al., 2002]. IgG-аутоантитела пациентов провоцировали поражение кожи у новорожденных мышей с клинической, гистологической и иммунологической картиной листовидной пузырчатки доноров. Подобные реакции указывают на то, что IgG1-аутоантитела к десмоглеину 1 у этих больных способны вызывать экспериментальную листовидную пузырчатку [Hacker-Foegen M. K. et al., 2002, 2003]. Однако было отмечено, что IgG1 и IgG4-аутоантитела к десмоглеину 1 у больных листовидной пузырчаткой демонстрируют различную тканевую и эпитопную специфичность [Arteaga L. A. et al., 2000; Lin M. S. et al., 2001]. Таким образом, IgG1-аутоантитела к десмоглеину 1 распознают как линейные, так и согласованные эпитопы и не связываются с кожей мыши, тогда как IgG4 распознают только согласованные эпитопы и могут связываться с кожей мыши. Результаты этих исследований позволяют предположить, что неспособность IgG1-аутоантител к десмоглеину 1 вызывать экспериментальную листовидную пузырчатку у новорожденной мыши происходит в связи с тем, что этот изотип аутоантител не вступает в реакцию с антигенами кожи мыши. Однако полученные данные не соответствуют теории о низкой патогенности аутоантител этого изотипа или о недостаточном количестве аутоантител, как предполагалось в прежних исследованиях [Lin M. S. et al., 2001]. Вероятно, у больных листовидной пузырчаткой присутствует два вида аутоантител: первые распознают согласованные эпитопы, а вторые связываются с линейными. Детальное изучение эпитопов выявило, что линейные десмоглеин 1 эпитопы не ограничены N-концом [Sekiguchi M. et al., 2001]. Последние, распознаваемые IgG-аутоантителами к десмоглеину 1 этих пациентов, распространены по всей эктоцепи десмоглеина 1. Однако в некоторых случаях отмечено отсутствие одинаковых десмоглеин 1 линейных эпитопов, распознаваемых аутоантителами листовидной пузырчатки [Arteaga L. A. et al., 2000; Santos S. N. et al., 2001]. Возможно, что появление аутоантител к линейным эпитопам десмоглеина 1 у пациентов с эндемической листовидной пузырчаткой является эпифеноменом аутоиммунного ответа, который развивается после разрушения эпидермиса, индуцированного патогенными антителами против десмоглеина 1, и последующим появлением эпитопов на эктоцепи десмоглеина 1. Подобный процесс является недоступным в интактной аутоиммунной реакции, то есть без вмешательства дополнительного активного патогенного фактора [Hacker-Foegen M. K. et al., 2002].
Ассоциация
антигенов-мишеней (десмоглеинов) с клиническими вариантами аутоиммунной пузырчатки
и десмоглеин-компенсаторная теория
Классическая вульгарная пузырчатка с первоначальным поражением слизистых оболочек, как описано выше, ассоциируется с IgG против десмоглеина 3 [Amagai M. et al., 1991; Gniadecki R., 2006]. Вместе с тем вульгарная пузырчатка с одновременным поражением кожи и слизистых оболочек — с IgG как против десмоглеина 3, так и против десмоглеина 1 (аутоантиген листовидной пузырчатки) [Emery D. J. et al., 1995; Gniadecki R., 2006; Kowalczyk A. P. et al., 1995]. Ряд исследователей предполагают, что в основе ассоциации специфических аутоантител с клиническими вариантами вульгарной пузырчатки лежит различная картина экспрессии десмоглеина 1 и десмоглеина 3 в многослойном и немногослойном плоском эпителии (рис. 4.9). Так, десмоглеин 1 экспрессируется в верхних слоях эпидермиса, т. е. в гранулярном (зернистом) слое, а десмоглеин 3 — преимущественно в супрабазальных слоях [Amagai M. et al., 1996; Shimizu H. et al., 1995; Waschke J., 2008]. В многослойном плоском эпителии, таком как слизистая оболочка полости рта, десмоглеин 3 экспрессируется на всем протяжении эпителиального пласта, тогда как десмоглеин 1 там представлен бедно. Подобное распределение десмоглеинов лежит в основе теории о том, что десмоглеин 3 является главным антигеном-мишенью для развития патологического процесса на слизистой оболочке полости рта и в меньшей степени — на коже. Теория была подтверждена и на генетически созданной мышиной модели с разрушенным десмоглеин 3-геном [Koch P. J. et al., 1997]. Такие мыши, нормальные при рождении, по мере взросления проявляли карликовый фенотип (низкий рост) и имели пузыри и эрозии на слизистой оболочке полости рта, ведущие к большой потере веса из-за препятствия прохождению пищи. На коже пузыри возникали только при ее травматизации.
В противоположность анти-десмоглеин 3 аутоантителам, аутоантитела против десмоглеина 1 не являются причиной возникновения пузырей на слизистых оболочках [Amagai M. et al., 1996; Shimizu H. et al., 1995]. Это было подтверждено исследованиями Amagai M. и соавт. (2000). Продемонстрировано, что токсин буллезного импетиго, являясь протеазом, избирательно разрушает десмоглеин 1. Подобное воздействие ведет к субкорнеальной отслойке, характерной для листовидной пузырчатки, и подтверждает теорию о том, что анти-десмоглеин 1 антитела являются причиной развития только листовидной пузырчатки [Amagai M. et al., 2000; Stanley J. R., Amagai M., 2006].
Взаимодействие анти-десмоглеин 1 и анти-десмоглеин 3 аутоантител ведет к образованию пузырей как на коже, так и на слизистых оболочках, что было продемонстрировано экспериментально рядом исследователей [Hertl M., 2005; Mahoney M. G. et al., 1999; Shirakata Y. et al., 1998]. Например, десмоглеин 1-реактивные IgG вводили в десмоглеин 3+/+ и десмоглеин 3-/- мышиные модели. На введение IgG листовидной пузырчатки у десмоглеин 3+/+ мышиной модели развивались небольшие пузыри на коже, тогда как у десмоглеин 3-/- мышиной модели — большие пузыри как на коже, так и на слизистых оболочках [Shirakata Y. et al., 1998]. Эти исследования объясняют появление у пациентов вульгарной пузырчаткой с анти-десмоглеин 3 аутоантителами высыпаний только на слизистых оболочках полости рта, а в случае анти-десмоглеин 1 аутоантител — на коже. Аутоантитела, направленные одновременно против десмоглеина 1 и десмоглеина 3, препятствуют десмосомальной адгезии в эпидермисе [Ding X. et al., 1997; Spindler V. et al., 2007].
Характерной (своеобразной) экспрессией антигенов-мишеней (десмоглеинов) ряд исследователей объясняют патогистологическое различие между вульгарной пузырчаткой (глубокой формы) и листовидной пузырчаткой (поверхностной формой) [Amagai M. et al., 1996; Bystryn J.-C., Rudolph J. L., 2005]. Пузыри при вульгарной пузырчатке располагаются глубоко в эпидермисе, над клетками базального слоя, а при листовидной пузырчатке — в самых поверхностных слоях, ниже зернистого слоя. Подобная гистологическая картина связана с «параллельным» залеганием аутоантигенов в различных слоях эпидермиса при двух клинических формах заболевания.
Как было указано выше, в нормальной коже человека десмоглеин 1 присутствует преимущественно в поверхностных слоях эпидермиса и отсутствует в супрабазальном слое, а десмоглеин 3, напротив, присутствует преимущественно в глубоких слоях и отсутствует в более поверхностном слое. Эти наблюдения привели исследователей к теории о том, что в случае потери функции одного десмоглеина (молекулы адгезии) под действием направленных против него аутоантител усиливается функция другого (десмоглеин-компенсаторная теория) [Amagai M., 2002; Bystryn J.-C., Rudolph J. L., 2005; Hanakawa Y. et al., 2002; Waschke J., 2008]. Согласно этой теории при вульгарной пузырчатке повреждения возникают только в глубоких слоях при сохранении функции десмоглеина 1. При листовидной пузырчатке, напротив, повреждения возникают более поверхностно в результате сохранения адгезивной способности десмоглеина 3. Теоретически при образовании антител против десмоглеина 3 формирование пузырей должно происходить во всех органах, покрытых многослойным плоским эпителием, в частности на слизистой оболочке полости рта. Однако, как показывает многолетний клинический опыт, нередко при вульгарной пузырчатке слизистые оболочки остаются видимо «здоровыми» (интактными). В этих случаях десмоглеин-компенсаторная теория не объясняет отсутствие видимых пузырей на слизистых оболочках, где экспрессия десмоглеина 1 в норме отсутствует. Кроме того, данная теория не объясняет отсутствие видимого тотального поражения кожного покрова при образовании антител против обоих десмоглеинов 3 и 1, функция которых нарушена.
Таким образом, несмотря на то, что изучение аутоиммунной пузырчатки с использованием различных методов на молекулярно-биологическом уровне позволило «приоткрыть» связь различных клинических проявлений пузырчатки с антигенами-мишенями, точный процесс развития патологии, в котором антитела являются причиной потери клеточной адгезии, остается до сих пор дискутабельным и требует дальнейшего углубленного изучения. Как показывает многолетний научно-клинический опыт, для возникновения и дальнейшего развития большинства аутоиммунных заболеваний, включая аутоиммунную пузырчатку, не всегда бывает достаточным присутствие основных вышеуказанных характеристик. Так, заболевание не развивается у родственников больных аутоиммунной пузырчаткой, в сыворотке которых обнаруживаются циркулирующие аутоантитела. При исследовании субклассовой характеристики иммуноглобулина G у пациентов и их родственников выявлены примерно одинаковые уровни иммуноглобулинов IgG1, IgG2, IgG3, лишь значительно выше уровень IgG4 у больных пузырчаткой [Bhol K. et al., 1994; Matzner Y. et al., 1995].
У здоровых родственников пациентов с обнаруженными циркулирующими аутоантителами в крови фиксированный иммуноглобулин класса G в местах антигенов-мишеней (межклеточной связывающей субстанции) многослойного плоского эпителия не выявляется, что свидетельствует о существовании гисто-иммунологических барьеров, препятствующих развитию столь угрожающего для жизни иммунопатологического процесса [Kricheli D. et al., 2000]. Какие же факторы способствуют ослаблению или разрушению этого барьера? Вопрос остается до сих пор энигмой для многих клиницистов и исследователей, занимающихся данной патологией.
Иммунная система и факторы, способствующие возникновению аутоиммунной пузырчатки
Более века назад Мечников И. И. (1901) высказал мысль о том, что основная биологическая функция иммунной системы заключается в «обеспечении и поддержании состояния гармонии организма в условиях постоянного давления среды», т. е. участия имунной системы в поддержании общего гомеостаза [Сильверстайн А. М., 1987; Metchnikoff E., 1968]. Иммуноциты не следует рассматривать только в качестве «жандармов организма», их участие в межвидовой борьбе «хозяин — паразит» является лишь частным проявлением глобальной биологической функции иммунной системы [Полетаев А. Б., 2005; Cohen I. R., Young D. B., 1991]. В дальнейшем, благодаря клиническим наблюдениям и экспериментальным работам ряда ученых, стало очевидным, что в осуществлении гомеостатической роли иммунной системы одной из главных функций является защита организма от продуктов распада клеток (физиологическая деструкция) [Ашмарин И. П., 2005; Avrameas S., Ternynck T., 1995; Cohen I. R., Atlan H., 1989; Schwartz R. H., 1998]. При этом ключевая роль принадлежит естественным аутоантителам и аутореактивным Т-лимфоцитам [Oppezzo P., Dighiero G., 2003; Singh N. J., Schwartz R. H., 2006].
У здоровых людей в сыворотке крови в норме в малых количествах присутствуют аутоантитела к многочисленным (десяткам тысяч) собственным антигенам (молекулярным соединениям), таким как антигены ядра клеток, компоненты цитоскелета, миелина, коллагенов, клеток сердечной и почечной тканей, эритроцитов, фибробластов, нервных клеток, эндогенные медиаторы и другие антигены [Гусев Е. И. с соавт., 2005; Мягкова М. А., Копоров Д. С., 2005; Полетаев А. Б., 2002, 2007; Шумилина Л. В., Полетаев А. Б., 2005; Ярилин Н. Н., 1999]. Синтез этих аутоантител программируется еще во внутриутробном периоде. На протяжении всей жизни постоянно продуцируются тысячи молекул естественных аутоантител. Титр естественных антител нарастает с возрастом под действием разных факторов, в том числе инфекционных заболеваний и лекарственной терапии [Петров Р. В., 1987; Röcken M., Biedermann T., 2005]. Однако аутоантитела не всегда вызывают аутоиммунную патологию. Для развития истинного аутоиммунного заболевания требуется не только взаимодействие аутоантител и антиген-специфических лимфоцитов с неизмененными аутоантигенами органов и тканей, вызывающих их деструкцию и/или хронические воспалительные реакции, но и большое число дополнительных патогенетических факторов и нарушений в системе «охраны» организма [Полетаев А. Б., 2007; Уоллис Д. с соавт., 2000; Schwartz R. H., 1998]. Так, при естественной или инициированной гибели клетки, а также при несовместимых с ее существованием нарушениях во внешнюю по отношению к клетке среду выбрасываются внутриклеточные антигены, которые способствуют проявлению «санитарной функции» иммунной системы с целью удаления продуктов распада и сохранения морфологической структуры тканей [Михайленко А. А. с соавт., 2005].
В частности, интересно наблюдение о состоянии иммунной системы при стрессовых воздействиях (внешних и внутренних), нарушающих гомеостатическое равновесие в организме [Loizzo A. et al., 2005; Winfield J. B., Jarjour W. N., 1991]. Известно, что ответ организма на стресс сопровождается активацией ряда защитных механизмов с выбросом гормонов и нейромедиаторов. При этом индукторами стресса могут быть различные факторы, например боль, изменение температуры, шум, психологические раздражители (страх, тревожность). Экспериментально показано, что во время первой недели жизни грызунов и во взрослом состоянии даже небольшие изменения во внешней или внутренней среде могут оказывать влияние на развитие важных нейроэндокринных структур и вести к стойким изменениям, таким как поведенческие, метаболические, иммунологические и эндокринные нарушения [Loizzo A. et al., 2005]. Отмечено, что на антигены поврежденных структур, участвующих в стрессе, вырабатываются короткоживущие антитела, которые выполняют функцию «ассенизаторов». Постоянные и/или часто повторяющиеся стрессы вызывают более длительное пребывание этих антител в организме человека, способствуя нарушению гомеостатических реакций. Последнее может провоцировать развитие аутоиммунной патологии, опухолей и склероза [Tomer Y. et al., 1998; Winfield J. B., Jarjour W. N., 1991].
При тщательном сборе анамнеза все пациенты, которые находились под нашим наблюдением, связывали начало аутоиммунной пузырчатки с предшествующим сильным психоэмоциональным перенапряжением, но одновременно пациенты отмечали и воздействие дополнительных факторов, провоцирующих это заболевание. Так, в 43% случаях больные вульгарной пузырчаткой отмечали активность заболевания после приема курса антибиотиков [Давиденко Е. Б., Махнева Н. В., 2012]. Роль лекарственных препаратов при развитии аутоиммунной пузырчатки известна уже давно.
За последние 25 лет накопилось немало сообщений, которые связывают возникновение пузырчатки с медикаментами группы тиола, содержащими сульфгидрильные радикалы (Д-пеницилламин, каптоприл, перитол, карбимазол, пироксикам), и антибиотиками группы бета-лактамов [Махнева Н. В. с соавт., 2004; Duhra P., Foulds I. S., 1988; Enjolras O. et al., 1987; Meunier L. et al., 1990]. Речь идет о цефалоспоринах, пенициллине, ампициллине.
Представлены описания развития пузырчатки после приема производных пиразолона (аминофеназон, аминопирин, азапропазон, норамидопирин) и других лекарственных препаратов: аценокумарол, героин, имиквимод, иммуномодуляторы (интерлейкины, интерфероны), изотретиноин, ацетилсалицилат, фенобарбитал, прогестерон, пропранолол [Brenner S. et al., 1998; Enjolras O. et al., 1987; Niizeki H. et al., 1994].
По нашим данным 51% больных вульгарной и 28% больных себорейной пузырчаткой длительно принимали либо гипотензивные (группа ингибиторов ангиотензинпревращающего фермента и β-адреноблокаторов), либо нестероидные противовоспалительные препараты [Давиденко Е. Б., Махнева Н. В., 2012].
После приема лекарственных препаратов развитие пузырчатки может происходить двумя путями [Niizeki H. et al., 1994; Ruocco V. et al., 1988; Vaillant L., 1991; Zone J. et al., 1982]:
1. Аутоиммунный, при котором индуктор (медикамент) способен изменять молекулы поверхности кератиноцитов, приводящих к образованию измененных, денатурированных неоантигенов. Этот процесс способствует формированию аутоантител и началу аутоиммунизации, которая обусловлена либо присутствием слабого генетического участка, либо нарушением механизмов регуляции иммунитета по типу ослабления супрессивной функции. Последнее приводит к активации лимфоцитов Т-хелперов, способствующей формированию аутоантител против антигенов кератиноцитов. Такая активация Т-хелперов при одновременном подавлении активности Т-супрессоров вызывает нарушение гомеостаза в организме и развитие аутоиммунных процессов;
2. Второй механизм развития пузырчатки — способность индуктора непосредственно действовать на молекулы адгезии, разрушая ее. В этом случае акантолиз возникает без вмешательства аутоантител, появление которых в крови является уже следствием повреждения ткани. Речь идет о токсическом, или биохимическом, пути развития, связанного со свойством соединений, имеющих сульфгидрильные группы, вызывать акантолиз.
Учитывая, что химические группы входят в состав ряда пищевых продуктов, диета и исключение «опасных» продуктов из рациона больных пузырчаткой имеет немаловажное значение [Brenner S., Wolf R., 1994; Chorzelski T. P. et al., 1996; Okezie B. O., Kosikowski F. V., 1982; Ruocco V. et al., 1996]. На это указывают и сами пациенты, которые до начала заболевания злоупотребляли приемом в пищу чеснока или лука-порея.
В исследованиях in vitro показано, что входящие в состав чеснока химические вещества — аллимеркаптан, аллиметилсульфид, аллисульфид — способны вызывать акантолиз [Brenner S. et al., 1995]. Группа тиола встречается не только в чесноке, луке, но и горчице, хрене, брокколи, цветной капусте [Okezie B. O., Kosikowski F. V., 1982].
Триггерными факторами при пузырчатке могут быть и пищевые продукты, содержащие группу фенольных соединений — танины [Теплюк Н. П. с соавт, 2011; Feliciani C. et al., 2007; Hunt A. F., Reed M. I., 1990; Lynfield Y. L. et al., 1973; Muzykantov V. R. et al., 1993]. Этими продуктами являются маниока (или юкка), манго, гуарана, орех кола, черный грецкий орех, малина, вишня, клюква, ежевика, розмарин, ванилин, кофе, семена какао, корни имбиря, женьшеня и чеснока, чай, матэ, различные специи, такие как кориандр, тмин, черный перец, чеснок [Okezie B. O., Kosikowski F. V., 1982].
По данным литературы возможна ложная реакция, связанная с аутофлюоресценцией некоторых веществ, проникающих в эпидермис [Palleschi G. M. et al., 1992]. Так, у пациентки, которая длительное время употребляла ежедневно по 2 кг апельсинов, наблюдалась картина аутофлюоресценции каротина на поверхности рогового слоя и в межклеточных пространствах эпидермиса.
Еще одним фактором, способным вызвать развитие заболевания, является длительный контакт с различными химическими веществами [Krain L. S., Bierman S. M., 1974]. В анамнезе многих пациентов с пузырчаткой указывается на длительный контакт с различными пестицидами и материалами для работы в саду, такими как фосфамиды, хромовые соли и пентахлорфенолы [Бутов Ю. С. с соавт., 2011; Lambert J. et al., 1986; Tsankov N. et al., 1990]. По нашим данным триггерным фактором пузырчатки у 20% больных вульгарной пузырчаткой, 50% — вегетирующей и 14% — себорейной пузырчаткой явился длительный контакт (от 2 до 20 лет) с такими химическими веществами, как технические масла, цемент, пары бензина, ртути, сероуглерода и кислот, неорганические удобрения, соли тяжелых металлов, битум, гальванические вещества [Давиденко Е. Б., Махнева Н. В., 2012].
Одним из известных триггерных факторов при пузырчатке является воздействие ультрафиолета [Cram D. L., Fukuyama K., 1972; Hogan P., 1992; Korman N., 1988]. По данным ряда авторов до начала заболевания около 40% больных пузырчаткой непрерывно подвергались воздействию ультрафиолета не менее 5 лет [Wohl Y., Brenner S., 2003]. По нашим данным длительная и частая инсоляция наблюдалась у 43% больных вульгарной пузырчаткой, 85% — себорейной и 50% — листовидной пузырчаткой [Давиденко Е. Б., Махнева Н. В., 2012].
Появление циркулирующих антител, направленных против антигенов эпидермиса, в том числе антигенов десмосомального аппарата, является обычным явлением после ожога, однако не сопровождает буллезную манифестацию, подобную буллезным дерматозам [Hogan P., 1992; Kudejko J. et al., 1973; Qureishi T. et al., 1995]. Вместе с тем химический и тепловой факторы часто являются триггерами заболевания и иммуногенными стимуляторами, способными вызвать гуморальную реакцию, в том числе появление истинных аутоантител пузырчатки и клиническое проявление заболевания.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.
